La ausencia de protocolos específicos de seguimiento dificulta el conocimiento de la repercusión de la prematuridad tardía en el desarrollo psicomotor. El objetivo es evaluarlo a los 4 años y compararlo con los nacidos a término (AT).
Población y métodoEstudio de cohortes retrospectivo de 90 prematuros tardíos (PT) y 89 AT sanos, a los 48 meses, evaluados mediante el Ages & Stages Questionnaires® (ASQ-3). Las variables continuas se describen mediante media±DE comparadas con el test de la t de Student para muestras independientes; las variables categóricas, mediante frecuencias y proporciones, comparadas con el test de independencia de la chi al cuadrado. Se determinó un punto de corte para la puntuación total del ASQ-3 capaz de discriminar el riesgo de déficit del desarrollo mediante un análisis ROC. Una selección step-wise para el modelo de regresión logística determinó los factores de riesgo asociados.
ResultadosLas puntuaciones medias de cada dominio y de la puntuación global del ASQ-3 no mostraron diferencias entre ambos grupos. Sin embargo, al analizar la densidad de probabilidades para la puntuación global del ASQ-3 ≤ 251 puntos, 15 PT (16,6%) y 4 AT (4,5%) mostraban riesgo de déficit psicomotor, y la prematuridad tardía y la ausencia de lactancia materna resultaron factores asociados significativamente.
ConclusionesHubo una mayor prevalencia de riesgo de déficit en el desarrollo en los PT, lo que justifica considerar esta población de riesgo y establecer programas de seguimiento eficientes. Debe seguirse investigando si este riesgo corresponde a toda la población o si existen factores biológicos o antecedentes perinatales que los hacen más vulnerables.
Lack of specific monitoring protocols hinders the knowledge of the impact of late prematurity on delayed psychomotor development. The objective of this study is to evaluate this at 48 months and compare it with those born at term.
Population and methodsA retrospective cohort study was conducted on 90 late preterm (PT) and 89 term (AT) healthy children at 48 months, assessed by the Ages & Stages Questionnaires® (ASQ-3). Continuous variables described using mean and standard deviation compared with the t Student t test for independent samples. The categorical variables were described as frequencies and proportions, compared with the Chi-square test of independence. A cut-off was determined for the total score of ASQ-3 able to discriminate the risk of developmental deficit by a ROC analysis. A step-wise logistic regression model identified the associated risk factors.
ResultsThe mean scores for each domain and overall ASQ-3 score showed no differences between groups. However, when analyzing the probability density for the ASQ-3 total score of ≤251 points, 15 PT (16.6%) and 4 AT (4.5%) showed risk of psychomotor deficits, and late prematurity and lack of breastfeeding were significantly associated factors.
ConclusionsThere is an increased prevalence of risk of development deficit in the PT, which justifies considering this population at risk and establishing effective monitoring programs. It should be further investigated whether this risk corresponds to the entire population, or if there are biological factors or perinatal history that makes them more vulnerable.
En el año 2005, se reconoció la vulnerabilidad de los prematuros tardíos (PT), definidos como aquellos nacidos entre las 34+0 y las 36+6 semanas de gestación, descartando la antigua denominación de «casi a término» que otorgaba una menor consideración del riesgo real de esta población1.
Son numerosas las publicaciones que muestran la mayor morbimortalidad neonatal de los PT comparada con los nacidos a término2-4.
La ausencia de programas específicos de seguimiento ha hecho muy difícil llegar a conclusiones definitivas sobre su evolución neurológica a corto y medio plazo. La casi totalidad de datos obtenidos son retrospectivos y con resultados dispares, aunque la mayoría apunta hacia la mayor incidencia de problemas de conducta, cognitivos y dificultades en el aprendizaje cuando se comparan con niños nacidos a término5-7.
Un gran porcentaje de estos niños no son suficientemente evaluados desde el nacimiento, desconociéndose si presentaban lesiones asociadas a la causa de la prematuridad o secundarias a la morbilidad neonatal. Los PT son seguidos por su pediatra de atención primaria o médico de familia, sin programas específicos de seguimiento para esta población, como sí ocurre con los prematuros extremos. En EE. UU., de un 5 a un 15% de la población infantil presenta déficits en su desarrollo y, en ausencia de pruebas de evaluación sistematizadas, solo el 30% de ellos son diagnosticados antes de la edad escolar8. Por este motivo, se recomienda la aplicación de escalas de cribado estandarizadas a edades específicas o frente a factores de riesgo9. La escala de Bayley10 es considerada como el estándar para la evaluación completa del desarrollo en niños pero requiere, para su aplicación universal, un alto coste en tiempo y personal altamente especializado.
Con el propósito de suplir dichas dificultades se han desarrollado cuestionarios para padres o cuidadores principales. Estos instrumentos han demostrado ser válidos y fiables. El más ampliamente utilizado es el Ages and Stages Questionnaires® (ASQ), desarrollado en la Universidad de Oregón, posteriormente actualizado y validado en varios países11, traducido al español12 y validado en Chile13,14 y en España, en Galicia15.
El reconocimiento de «población de riesgo» de los PT, así como la posibilidad de disponer de una herramienta fácil y fiable de cribado de déficits del desarrollo, facilitaría el conocimiento real, a corto y largo plazo, de esta población y proporcionaría la posibilidad de un diagnóstico y un abordaje terapéutico más precoces.
El objetivo de este estudio fue evaluar, mediante un cuestionario respondido por sus padres, el desarrollo psicomotor a los 48 meses de edad de los PT nacidos en nuestro centro durante el año 2009 y compararlo con el de recién nacidos a término (AT) sanos, con el fin de comprobar la hipótesis de que los PT presentan el doble de riesgo de dificultades en su desarrollo psicomotor que los nacidos a término16,17.
Población y métodoEstudio de cohorte retrospectivo. Se reclutó a los PT nacidos en un hospital privado de una aseguradora sanitaria, con Unidad de Neonatología de nivel asistencial IIIB18. Se constituyeron 2 grupos:
Grupo de estudio: se incluyó a prematuros de 34+0 a 36+6 semanas de gestación nacidos en el hospital el año 2009 y que, a lo largo del año 2013, cumplieran 48 meses. Se excluyeron síndromes malformativos, enfermedad genética o metabólica conocida.
Grupo control: formado por recién nacidos AT, de edad gestacional entre 38+0 y 41+6 semanas, gestación única, nacidos en el mismo período del grupo de estudio y aparentemente sanos. Se excluyeron a los ingresados en el período neonatal y los síndromes malformativos. Se eligió un recién nacido AT por cada PT incluido en el estudio, pareado por fecha de nacimiento.
El total de PT nacidos en ese período fue de 155 (8,7% de los nacidos vivos). Se realizó contacto telefónico con sus padres para explicar el significado del estudio y solicitar su participación. De todos ellos, 90 (57%) aceptaron y los restantes o no aceptaron o no fue posible su localización. Se analizó que no hubiera un sesgo significativo entre la población de PT estudiada y la de excluidos.
El grupo control lo constituyeron 90 nacidos AT, tras contacto telefónico y aceptación, en el 100% de los casos, por parte de sus padres. Uno fue eliminado por comprobar que su gestación fue de 42 semanas.
Se recogieron como variables, en ambos grupos, peso al nacer, edad gestacional valorada según datos obstétricos de fecha de última regla y control ecográfico, género, gemelaridad, forma de finalización del parto, vaginal o cesárea, e ingreso en la Unidad de Neonatología. En este último caso, se registraron las incidencias: patología respiratoria, hiperbilirrubinemia que precisó fototerapia, apneas, hipoglucemia (< 40mg/dl primeras 48 h), requerimiento de asistencia respiratoria (ventilación mecánica o CPAP) o cirugía. Se recabó información sobre alimentación con leche materna superior a un mes de vida posnatal, edad materna en el momento de la evaluación, formación académica de los padres, hábito familiar monoparental y reingreso posnatal dentro del primer año de vida. Se consideró como homogéneo el nivel socioeconómico (medio-alto) al disponer, como característica común, capacidad suficiente para costear un seguro privado de asistencia sanitaria. Se anotó la edad en que se realizó la evaluación.
La evaluación del desarrollo psicomotor se realizó mediante un cuestionario, ASQ-3 en español12, a completar por los padres de los niños, a la edad de 48 meses. Según el manual, su elaboración era válida entre los 45 y 50 meses y 30 días, procurando fuera lo más cercana posible a los 48 meses.
Se ofreció a los padres la posibilidad de completar el cuestionario por correo electrónico o mediante la visita a domicilio de una persona, no profesional sanitario, que ejerció solo de portadora del documento y asesoramiento. Y de los nacidos AT, si los padres lo preferían, podían cumplimentarlo en la consulta de su pediatra o por correo electrónico. Se les entregaba una documentación en la que se incluía: informe explicativo del proyecto, cuestionario de evaluación y documento de consentimiento informado.
Una vez recogida la documentación y obtenida la evaluación, se informó a los padres del resultado vía correo electrónico o, en caso de detectar anomalías, se les citó para una visita presencial a fin de aconsejar la forma de reconducir la evolución del niño, tras contacto previo con su pediatra.
El proyecto fue aprobado por la Comisión de Docencia y Ética del Hospital.
Instrumento de evaluación: la evaluación del desarrollo psicomotor se realizó mediante un cuestionario, ASQ-3 en español12. Deben responderlo los padres, es muy fácil de comprender y rápido para completar. Existen 21 versiones, adecuadas a cada edad, desde los 2 a los 60 meses. Cada una de ellas consta de 5 dominios del desarrollo: comunicación, motor grueso, motor fino, resolución de problemas y sociabilidad. En cada apartado se formulan 6 preguntas sobre actuaciones del niño, a las que debe responderse: «sí, lo hace habitualmente (10 puntos)», «solo a veces (5 puntos)» o «todavía no lo realiza» (0 puntos). El resultado se obtiene por la suma de cada dominio y la global. Así mismo, constan 9 preguntas que los padres deben responder de forma directa y subjetiva, acerca de algunos aspectos del desarrollo y conducta de su hijo. La suma total y las parciales se cotejan con los cut-off o puntos de corte marcados por el método, catalogando el resultado de óptimo, intermedio o bajo para su edad, este último equivalente al valor promedio-2 DE. En el caso de situarse en la zona de resultado negativo en al menos un dominio o área evaluada, se aconseja acudir a realizar pruebas de diagnóstico más elaboradas con el fin de refrendarlo e iniciar la terapia adecuada.
Para el presente estudio se utilizó la versión ASQ-3 de 48 meses, intentando que fuera realizada lo más cerca posible de los 48 meses.
Método estadísticoPara el cálculo del tamaño muestral se consideró una potencia del 80%, una significación del 5% y un riesgo relativo estimado de 2,216,17, suponiendo que la tasa de riesgo en el grupo de nacidos AT es del 15%9. Se obtuvo un tamaño muestral de 89 niños por grupo.
Las variables continuas fueron descritas mediante el valor promedio (media) ± DE, y su comparación se obtuvo mediante el test de la t de Student para muestras independientes. Las variables categóricas fueron descritas mediante frecuencias y proporciones, y comparadas mediante el test de independencia de la chi al cuadrado.
Se determinó un punto de corte para la puntuación total del ASQ-3 que fuera capaz de discriminar el riesgo de déficit del desarrollo psicomotor (DPM), mediante un análisis ROC. Dicho punto fue fijado en 251, consiguiendo una sensibilidad superior al 85,5%. Mediante el test de Kolmogorov-Smirnov, se encontró que la distribución de probabilidades de la puntuación total no era significativamente distinta entre los PT y los AT para valores mayores al punto de corte. Este punto de corte se comparó con el punto de cohorte teórico, resultante del obtenido al restar 2DE del valor promedio en la muestra normativa (AT).
Mediante una selección step-wise para el modelo de regresión logística con respuesta binaria riesgo-no riesgo, con probabilidad de retención de 0,05, se generaron 2 modelos, el primero incluía los factores de riesgo biodemográficos/perinatales (sexo, edad gestacional, edad realización ASQ-3, edad materna, formación materna, hábito monoparental, parto por cesárea, lactancia materna), y el segundo, factores clínicos relacionados con morbilidad perinatal (ingreso neonatal, distrés respiratorio, ventilación mecánica y/o CPAP, apneas, sepsis, hipoglucemia, hiperbilirrubinemia, cirugía, reingreso posnatal).
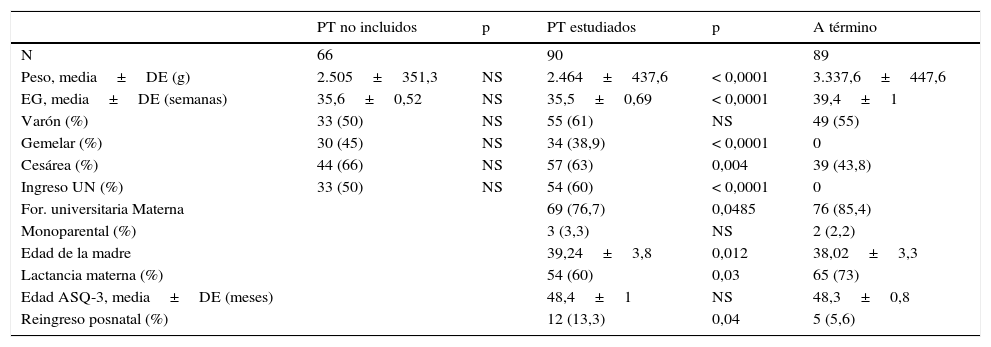
ResultadosEn la tabla 1 se muestran las características de la población estudiada. Se observa que no existen diferencias entre PT evaluados y los que no se consiguió su participación. Las diferencias apreciadas entre PT y AT en peso, edad gestacional, gemelaridad, tasa de cesárea e ingreso en neonatología son las esperadas teniendo en cuenta los criterios de selección de los AT. Sin diferencias en sexo, hábito monoparental y edad en la realización del ASQ-3, sí existían en la formación universitaria y tasa de lactancia materna, siendo superiores en el grupo control. La edad materna en el grupo de PT fue un año mayor comparada con el grupo AT y el reingreso posnatal en el primer año de vida fue significativamente superior en los PT. La edad de realización del test fue de 47 a 50 meses, con una media de 48,4±1 y sin diferencias entre ambos grupos.
Descripción de la muestra
| PT no incluidos | p | PT estudiados | p | A término | |
|---|---|---|---|---|---|
| N | 66 | 90 | 89 | ||
| Peso, media±DE (g) | 2.505±351,3 | NS | 2.464±437,6 | < 0,0001 | 3.337,6±447,6 |
| EG, media±DE (semanas) | 35,6±0,52 | NS | 35,5±0,69 | < 0,0001 | 39,4±1 |
| Varón (%) | 33 (50) | NS | 55 (61) | NS | 49 (55) |
| Gemelar (%) | 30 (45) | NS | 34 (38,9) | < 0,0001 | 0 |
| Cesárea (%) | 44 (66) | NS | 57 (63) | 0,004 | 39 (43,8) |
| Ingreso UN (%) | 33 (50) | NS | 54 (60) | < 0,0001 | 0 |
| For. universitaria Materna | 69 (76,7) | 0,0485 | 76 (85,4) | ||
| Monoparental (%) | 3 (3,3) | NS | 2 (2,2) | ||
| Edad de la madre | 39,24±3,8 | 0,012 | 38,02±3,3 | ||
| Lactancia materna (%) | 54 (60) | 0,03 | 65 (73) | ||
| Edad ASQ-3, media±DE (meses) | 48,4±1 | NS | 48,3±0,8 | ||
| Reingreso posnatal (%) | 12 (13,3) | 0,04 | 5 (5,6) |
ASQ-3: Ages & Stages Questionnaires;·DE: desviación estándar; NS: no significativa; PT: prematuro tardío; UN: Unidad de Neonatología.
Las puntuaciones medias en cada uno de los dominios y en el rendimiento global del ASQ-3 no mostraron diferencias entre los PT y los AT (tabla 2).
Puntuaciones obtenidas en el ASQ-3 a los 48 meses de edad
| Puntuación ASQ-3 (media±DE) | Prematuro tardío (n=90) (media ±DE) | A término (n=89) (media ±DE) | p |
|---|---|---|---|
| Comunicación | 57,28±6,28 | 57,92±3,97 | NS |
| Motor grueso | 55,22±5,95 | 55,84±6,04 | NS |
| Motor fino | 52,22±9,18 | 54,21±7,19 | NS |
| Resolución de problemas | 56,33±6,66 | 57,08±5,05 | NS |
| Sociabilidad | 55,78±5,98 | 55,78±5,59 | NS |
| Global | 275,63±24,05 | 280,17±15,93 | NS |
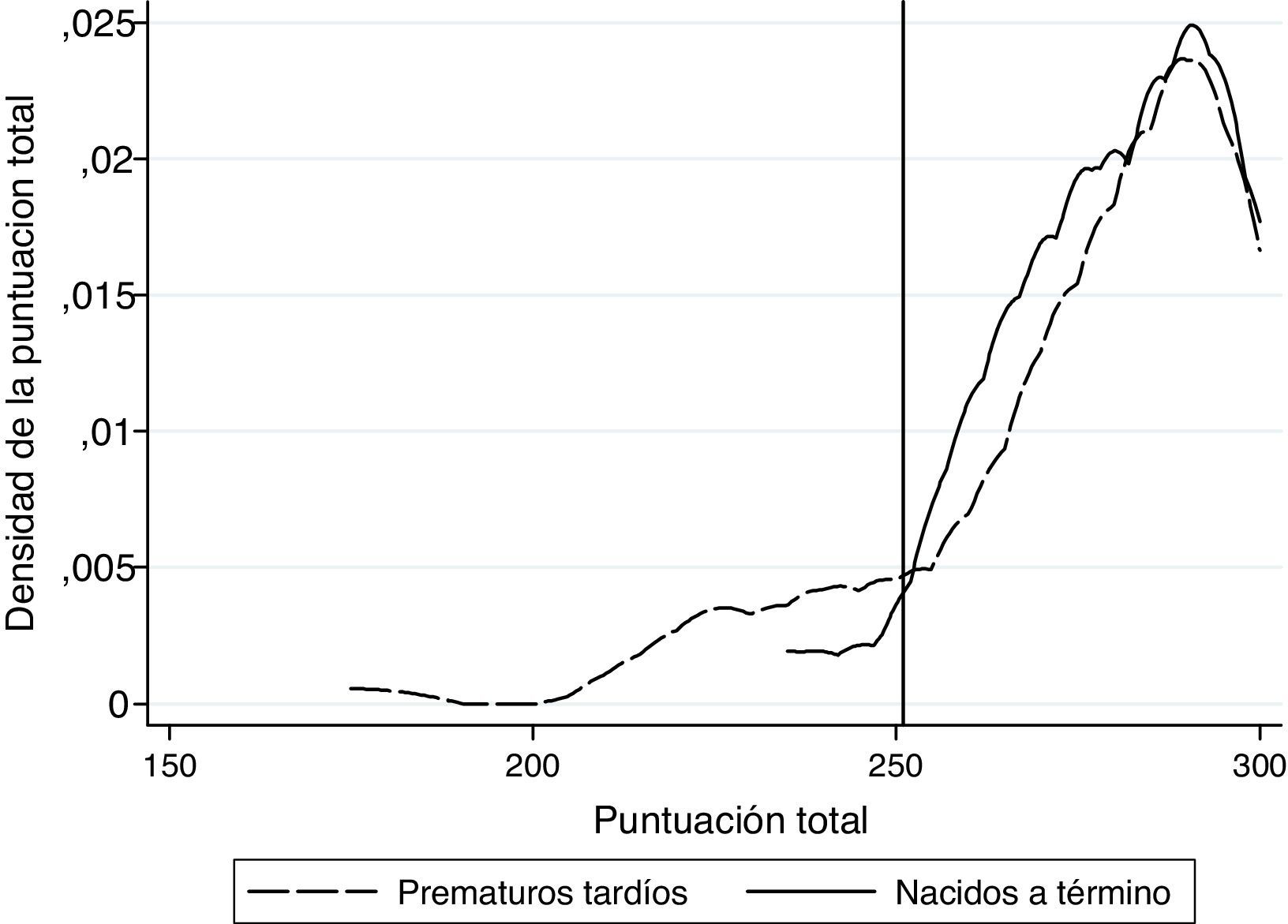
Al hacer un gráfico de la densidad de probabilidades para una puntuación total del ASQ-3, se observó que ambos grupos tienen una distribución equivalente a partir de los 251 puntos de puntuación total, y que bajo ese punto, hay más PT con puntuaciones bajas (fig. 1). Dicho punto de corte fue concordante con la media-2 DE de la muestra de referencia de niños AT. El análisis ROC mostró una sensibilidad > 85,5% para este punto. La prueba de Kolmogorov-Smirnov no mostró evidencia de distribución de probabilidades diferente entre ambos grupos, en puntuaciones superiores al punto de corte (p=0,68). A partir de dicho análisis, se consideró riesgo de DPM una puntuación igual o inferior a 250.
Al dicotomizar los grupos según el punto de corte, 19 niños aparecen con riesgo de déficit del DPM, de ellos 15 son PT (16,67%) y 4 AT (4,5%).
En el modelo de regresión logística, con variables explicativas biodemográficas/perinatales resultaron significativas la prematuridad tardía (OR 3,68, IC del 95%, 1,14-11,81, p=0,03) y la ausencia de lactancia materna (OR 3,3, IC del 95%, 1,22-9,3, p=0,02). Mientras que en el modelo con variables explicativas clínicas relacionadas con morbilidad perinatal, solo la prematuridad fue significativa (OR 5,06, IC del 95%, 1,6-15,98, p=0,006) (tabla 3).
Variables asociadas significativamente al riesgo de déficit de DPM según modelo de regresión logística
| Modelo 1 Variables biodemográficas/perinatales | Modelo 2 Variables clínicas | ||
|---|---|---|---|
| Variables significativas | OR (IC del 95%), p | Variables significativas | OR (IC del 95%), p |
| Prematuridad tardía | 3,68 (1,14-11,81), p = 0,03 | Prematuridad tardía | 5,06 (1,6-15,98), p = 0,006 |
| Ausencia de lactancia materna | 3,3 (1,22-9,3), p = 0,02 | ||
La puntuación promedio global en el ASQ-3, equivalente en los PT comparada con la obtenida en los AT, parece no dar validez a la hipótesis inicial del trabajo. Lo mismo podemos decir de cada uno de los dominios explorados por el cuestionario, en los que no se observan diferencias entre ambos grupos.
Sin embargo, al considerar la distribución de la puntuación global en esta muestra de características privilegiadas, aparecen diferencias, de modo que los PT tienen mayor riesgo de déficit del DPM que los nacidos AT.
Estos resultados invitan a una profunda reflexión sobre su significación clínica a largo plazo.
Una objeción podría centrarse en el porcentaje elevado de PT no participantes. Las dificultades en su localización entorpecieron su inclusión. No así con los AT pareados puesto que, con mayor número de candidatos, se reclutó a aquellos que fueron localizados y cumplían los criterios de inclusión. Sería deseable contar con mayor número de PT pero el llegar al número mínimo exigido por el cálculo muestral y que entre ambos grupos no se hallaran diferencias en edad gestacional, peso, género y morbilidad neonatal hicieron presumir la ausencia de sesgo por este motivo.
Otro aspecto que se debe tener en cuenta son las características de la población, con un nivel socioeconómico medio-alto y con un alto porcentaje de formación universitaria de los padres, no comparable, posiblemente, con otras de diferente nivel socioeconómico y cultural publicadas. La influencia de ambos niveles es cada vez más evidente, tanto en su asociación como factor independiente en la morbilidad neonatal19, como en el desarrollo neurológico a largo plazo, incrementando el riesgo de déficit en el DPM cuando ambos niveles son bajos20,21. Los resultados obtenidos contrastan con las puntuaciones en el ASQ-3 de niños con DPM en Chile a los 8, 18 y 30 meses14,22.
La realización de este estudio a los 48 meses no es aleatoria, puesto que puede considerarse como el último peldaño para la detección de déficits susceptibles del beneficio de una terapia23. La principal dificultad en la aplicación de este cuestionario estriba en la falta de validación en nuestro país. Sí se ha realizado en español en otras edades inferiores en Santiago de Chile13,14 y en Galicia15. Se considera como un excelente método de cribado de dificultades del desarrollo en EE. UU., Holanda, Noruega, Canadá, Francia, Corea, Turquía, India, Irán y Brasil, países en los que se ha validado con test específicos para cada edad, con una sensibilidad y especificidad alrededor del 88 y el 82,5%, respectivamente24,25.
Considerar los déficits por dominios disminuye la sensibilidad y aumenta la especificidad de la prueba y es por ello que algunos autores han optado por utilizar la puntuación global como evaluación del desarrollo psicomotor26.
Teniendo en cuenta las características de la población estudiada y con un grupo control altamente seleccionado como referencia, se determinó el punto de corte basado en criterios estadísticos, resultando en 251 puntos. Y se observó que aparecía un mayor número de niños con déficits del DPM en el grupo de PT comparado con el grupo control AT (16,67% vs 4,5%, respectivamente).
Al aplicar el método de regresión para las variables demográficas y perinatales, solo resultaron significativamente asociadas al riesgo de déficit de DPM la prematuridad tardía y la ausencia de lactancia materna más allá del mes de vida, y al aplicarlo a las variables de morbilidad neonatal, solo la edad gestacional resultó significativa.
Para Schonhaut et al.22, en prematuros de 32 a 36 semanas de edad gestacional, género, crecimiento intrauterino restringido (CIR), gemelaridad e ingreso en cuidados intensivos neonatal (UCI), son factores probablemente asociados a un mayor riesgo de déficits en el DPM, y para Kerstjens et al., las gestaciones múltiples, CIR, hijos de madres obesas e hipoglucemia27,28. Ninguno de ellos figura como significativo en la población estudiada.
El ingreso en la Unidad de Neonatología va asociado a los diferentes protocolos hospitalarios. Sería quizás más indicado como variable el ingreso en UCI neonatal29, aunque no todos están de acuerdo en asociarla a mal pronóstico neurológico30.
Se debe destacar, en la población estudiada, la significación de la ausencia de lactancia materna. Es indudable que la leche materna es un estimulante beneficioso para la maduración cerebral de los PT, especialmente en la fase de mielinización en que se encuentran31,32. A su vez, es reconocida la dificultad en la instauración de una lactancia materna exitosa en estos niños por su inmadurez neurológica, con dificultades en la fuerza de succión y coordinación, por las dificultades en la lactogénesis materna y por la escasa o nula educación sanitaria en el período neonatal inmediato, favoreciendo reingresos hospitalarios por dificultades en la alimentación, malnutrición, hiperbilirrubinemia e hipoglucemia33.
Prematuridad tardía y morbilidad neonatal y posnatal parecen significativamente asociadas al riesgo de déficit del DPM19,34,35, siendo mayor cuanto menor sea la edad gestacional. Sin embargo, los hay que no aprecian diferencias en el desarrollo neurológico de los PT a los 12 meses36, ni problemas de conducta y aprendizaje en edad de escolarización37. Otros, por el contrario, sí detectan un menor rendimiento escolar a los 4 y 7 años en los PT38,39.
Si aceptamos el riesgo de esta población a presentar trastornos de la conducta, el lenguaje y el aprendizaje en edad preescolar y escolar, debemos ser conscientes de la importancia de disponer de una herramienta útil, fácil y fiable de detección precoz de riesgo de déficit de DPM. Sin embargo, el problema quizás reside en la adaptación y validación de este cuestionario a cada población, con los ajustes adecuados en los puntos de corte que determinan la normalidad. Es evidente la necesidad de alcanzar la máxima sensibilidad, pero evitando el excesivo número de falsos positivos, con la consecuente sobrecarga emocional para la familia y asistencial para los profesionales de la salud40.
ConclusionesEl estudio de seguimiento llevado a cabo muestra, atendiendo a la puntuación global en el ASQ-3, una mayor prevalencia de riesgo de déficit del DPM en los PT comparados con los nacidos AT con los criterios utilizados. Debe profundizarse en la consistencia de estos resultados para comprobar su significación clínica. Las características de la población, así como la ausencia de validación del método en nuestro país, son condicionantes a tener en cuenta. A pesar del amplio consenso, obtenido a través de los múltiples estudios publicados, de que los PT son una población de riesgo de presentar anomalías en su desarrollo, incluso hasta en la edad adulta, debe seguir investigándose si esta afirmación corresponde a toda la población o bien a aquellos con algunas variables perinatales determinantes para su evolución.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Mireia Corrales por su colaboración en la entrega, asesoramiento y recogida de cuestionarios en el domicilio de los padres. A Gabriel Cavada, bioestadístico chileno, por su asesoría estadística. A la Fundación Privada de la Sra Naccari Rava(‡), habitual colaboradora desinteresada del Hospital. A los pediatras, Pere Catalá, Xavier Costa, Dolors Cuadra, Esperança Llorens, Inmaculada Puig y Felipe Velasco por permitir la elaboración de los cuestionarios en sus consultas.