Tras la introducción de la VNC7 se ha objetivado una importante expansión de algunos serotipos emergentes (SNV) de Streptococcus pneumoniae, siendo los principales productores de enfermedad neumocócica invasora (ENI) actualmente. Nuestro objetivo ha sido describir los aspectos epidemiológicos, clínicos y microbiológicos de la ENI producida por SNV en un hospital terciario de Madrid.
Pacientes y métodosEstudio retrospectivo (1998-2004) y prospectivo (2005-2009) de los SNV productores de ENI. Se analizaron 3 periodos de estudio: P1 (1998-2001), sin comercialización de la VNC7, P2 (2002-2005), con una cobertura vacunal del 40% y P3 (2006-2009), con la vacuna incorporada al calendario vacunal de la Comunidad de Madrid.
ResultadosSe analizaron 155 casos de ENI, de los que se pudieron serotipar 150 aislamientos (100 de ellos SNV). Se produjo un incremento de la prevalencia de SNV desde P1 (31%) a P2 (53,6%) y P3 (91,3%). Los serotipos emergentes más prevalentes fueron 19A, 1, 5, 3, 7F y 15C. Los serotipos 1, 3, 5 y 15C produjeron, fundamentalmente, enfermedad respiratoria; el serotipo 19A tanto enfermedad respiratoria como bacteriemia primaria, siendo la principal causa de meningitis; el serotipo 7F produjo, fundamentalmente, bacteriemia primaria (66%). El 83,8% de los SNV fueron sensibles a penicilina.
ConclusionesDesde la introducción de la VNC7 se ha objetivado un aumento de la prevalencia de ENI producida por SNV. Estos cambios encontrados deberían hacer considerar la utilización de las vacunas antineumocócicas ampliadas para la prevención de ENI, al incluir la mayoría de los SNV emergentes.
There has been an increased incidence in invasive pneumococcal disease (IPD) produced by non-vaccine serotype (NVS) of Streptococcus pneumoniae after the introduction of PCV7. Our objective was to describe the epidemiological, clinical and microbiological characteristics of IPD caused by NVS in a tertiary hospital in Madrid.
Patients and methodsRetrospective (1998-2004) and prospective (2005-2009) study evaluating IPD caused by NVS in children. The study was divided into three periods: P1 (1998-2001) when PCV7 was not commercialized; P2 (2002-2005) with 40% vaccine coverage among children; and P3 (2006-2009) when the vaccine was added to the Childhood Immunization Schedule in Madrid.
ResultsWe analyzed 155 cases of IPD. One hundred and fifty of these isolates were serotyped (100 were NVS). There was an increase in the prevalence of IPD from P1 (31%) to P2 (54%) and P3 (91%). The most relevant emerging serotypes were 19A, 7F, 1, 5, 3 and 15C. The most significant clinical syndromes produced by some specific serotypes were as follows: lower respiratory tract infection (LRTI) by serotypes 1, 3, 5 and 15C; LRTI, primary bacteremia and meningitis by serotype 19A; and primary bacteremia by serotype 7F (66%). The large majority (83.8%) of NVS were sensitive to penicillin.
ConclusionsThere has been an increased prevalence of IPD caused by NVS since the introduction of PCV7. These changes should prompt the introduction of new pneumococcal vaccines, which include most of the NVS, in the childhood immunization calendar to prevent IPD in children.
La epidemiología de la enfermedad neumocócica invasora (ENI) ha variado sustancialmente en la última década de forma concomitante a la introducción de la vacuna antineumocócica heptavalente (VNC7). La VNC7, comercializada a partir del año 2000, ha reducido de forma muy significativa los casos de ENI producidos por los serotipos incluidos en la misma o serotipos vacunales (SV)1,2. La desaparición de estos serotipos ha sido paralela a la aparición de otros serotipos emergentes o serotipos no vacunales (SNV), que se han convertido en los principales agentes etiológicos de la ENI actualmente3,4. No obstante, la reciente implementación de las nuevas vacunas antineumocócicas ampliadas 10 valente (VNC10) y 13 valente (VNC13) en determinadas comunidades, como la Comunidad de Madrid (CAM), ya se está acompañando de cambios sustanciales en la epidemiología de la enfermedad, con una disminución de la incidencia de la misma5.
Estos cambios en los serotipos se han acompañado de importantes variaciones en las formas clínicas de presentación y en los patrones de resistencia antibiótica6,7. Por ello, la vigilancia epidemiológica de la ENI es imprescindible para conocer los principales patrones clínicos de presentación, lo que nos puede ayudar en el enfoque diagnóstico y, de este modo, en el tratamiento de los pacientes.
El objetivo de nuestro estudio fue describir los aspectos epidemiológicos, clínicos y microbiológicos de los principales serotipos emergentes de Streptococcus pneumoniae (SP) productores de ENI en nuestra área. Se realizó un análisis de los principales grupos de edad afectados, las principales formas clínicas de presentación y los rangos de resistencia de antibiótica y, de este modo, plantear la utilidad y posible implementación sistemática de las vacunas antineumocócicas conjugadas VNC10 y VNC13, que permitan optimizar la prevención del mayor número posible de serotipos de SP productores de ENI8,9.
Pacientes y métodosEstudio observacional, descriptivo de niños menores de 16 años diagnosticados de ENI en el Hospital General Universitario Gregorio Marañón de Madrid, durante un periodo de 12 años (enero de 1998 a diciembre de 2009). Este hospital es el centro de referencia del Área 1 de la Comunidad de Madrid, y atiende a un número de urgencias pediátricas que oscila entre 30.000-60.000 anuales.
Se incluyeron todos los pacientes con el diagnóstico de ENI, definida como aquel síndrome compatible con infección neumocócica, con aislamiento de SP de una muestra estéril (sangre, líquido cefalorraquídeo, pleural, articular o peritoneal), mediante cultivo o técnicas de PCR. El estudio consta de una fase retrospectiva durante el periodo 1998-2004, donde se revisaron las historias clínicas de los pacientes con ENI por medio de un archivo de aislamientos de SP, y una segunda fase durante el periodo 2005-2009, en la cual se analizaron los pacientes diagnosticados de ENI de manera prospectiva. Se recogieron variables epidemiológicas, clínicas y microbiológicas.
La VNC7 fue comercializada en junio de 2001 e incorporada al calendario sistemático de vacunación de la Comunidad de Madrid en el año 2006. Por esta razón, se dividió el estudio en 3 periodos: P1 (enero de 1998 a junio de 2001) en el que todavía no estaba comercializada la VNC7; P2 (julio de 2001 a diciembre de 2005) en el que la vacuna no estaba incluida dentro del calendario sistemático de vacunación, con una cobertura vacunal aproximada de un 40-50%; y P3 (de 2006 a 2009) en el que la vacuna fue incorporada al calendario sistemático de vacunación de la CAM (cobertura superior al 90%).
La identificación del SP se realizó según los protocolos de identificación fenotípica bacteriana, basados en las características «observables» de las bacterias (morfología, hemólisis, propiedades bioquímicas y metabólicas). El esquema de identificación se completó con la realización de una aglutinación en látex para neumococo, una prueba de sensibilidad a optoquina y un test de solubilidad en bilis. La serotipificación se realizó a través de la aglutinación en látex con antisueros específicos (Pneumotest, Statens Serum Institut, Glostrup, Dinamarca) en el laboratorio de referencia de neumococo (Instituto de Salud Carlos III). De este modo, se determinaron los SV (4, 6B, 9V, 14, 18C, 19F, 23F) y los SNV (resto de serotipos no incluidos en la VNC7). Para realizar el análisis de la resistencia antibiótica, el estudio de la concentración mínima inhibitoria (CMI) se basó en las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) por medio del método de microdilución en caldo, utilizando distintos paneles antibióticos comercializados (penicilina, eritromicina, cefotaxima, fluoroquinolonas y vancomicina) (tabla 1).
Valores de CMI (mg/l) utilizados según el CLSI
| Sensible | R intermedia | R elevada | |
| Penicilina | |||
| Extra-meníngeas | |||
| 2000 | ≤0,06 | 0,12-1 | ≥2 |
| 2008 | ≤2 | 4 | ≥8 |
| Meníngeas | |||
| 2000 | ≤0,06 | 0,12-1 | ≥2 |
| 2008 | ≤0,06 | 0,12-1 | ≥2 |
| Cefotaxima | |||
| Extra-meníngeas | ≤1 | 2 | ≥4 |
| Meníngeas | ≤0,5 | 1 | ≥2 |
| Macrólidos (eritromicina) | ≤0,25 | 0,5 | ≥1 |
| Quinolonas (levofloxacino) | ≤2 | 4 | ≥8 |
| Vancomicina | ≤1 | - | - |
El análisis estadístico se realizó mediante el programa SPSS 18.0. Se utilizó la prueba de Chi-cuadrado y el test exacto de Fisher para la comparación de proporciones. Las proporciones se expresaron en forma de porcentajes. La incidencia se calculó en función de las urgencias pediátricas atendidas en el hospital, y posteriormente se compararon las tasas de incidencia. Se consideraron significativos valores de p<0,05. Se solicitó consentimiento informado de los pacientes en la fase prospectiva y se garantizó la confidencialidad de los resultados en todo momento. El estudio fue aprobado por el Comité de Ética del Hospital Gregorio Marañón.
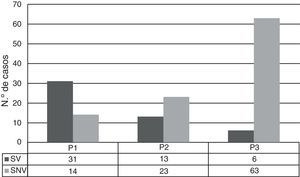
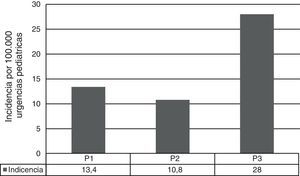
ResultadosSe analizaron un total de 155 casos de ENI: 50 producidos por SV, 100 producidos por SNV y 5 por SP no tipables. Previamente a la introducción de la VNC7 (P1), los SV suponían el 69% de los aislamientos, por lo que los SNV ya comprendían un 31%, siendo del 54 y 91% en P2 y P3, respectivamente (fig. 1). La incidencia de ENI debida a los SNV fue variando a lo largo del periodo del estudio, siendo en P1 de 13,4 casos por 100.000 urgencias pediátricas, en P2 de 10,8 y en P3 de 28 (P1 vs P3: p<0,01 y P2 vs P3: p<0,01) (fig. 2). El aumento más evidente de esta incidencia se produjo durante los últimos 4 años (P3), donde prácticamente la totalidad de los casos de ENI fueron producidos por SNV (91,3%). Este incremento supone un 210% respecto al inicio del estudio, y se produjo en un plazo de 4 a 5 años tras la comercialización de la VNC7.
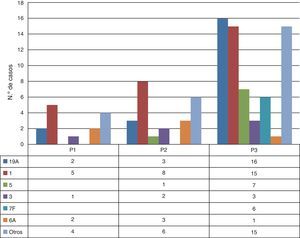
Las características epidemiológicas, microbiológicas y clínicas más relevantes de los casos de ENI producidos por los principales serotipos emergentes a lo largo del estudio se describen en la tabla 2. Es importante destacar que un número reducido de estos SNV (1, 19A, 5, 6A, 7F y 3) causaron el 70% de los casos de ENI en P3, serotipos no incluidos en la VNC7, pero sí en la VNC13. La evolución temporal de los SNV se refleja en la figura 3.
Características epidemiológicas y clínicas de los casos de ENI producidos por los principales serotipos emergentes (SNV)
| ST19A 21 (14%) | ST 1 28 (18,7%) | ST 5 8 (5,2%) | ST 3 6 (3,9%) | ST 7F 6 (3,9%) | ST 6A 6 (3,9%) | |
| Edad | ||||||
| <24 meses | 16 (76,1%) | 5 (17,8%) | 2 (25%) | 4 (66,6%) | 4 (66,6%) | 5 (83,3%) |
| 24-60 meses | 5 (28,5%) | 14 (50%) | 4 (50%) | 1 (16,6%) | 2 (33,3%) | 0 (0%) |
| >60 meses | 0 (0%) | 9 (32,1%) | 2 (25%) | 1 (16,6%) | 0 (0%) | 1 (16,6%) |
| Formas clínicas | ||||||
| Meningitis | 5 (23,8%) | 0 (0%) | 1 (12,5%) | 0 (0%) | 0 (0%) | 1 (17%) |
| Respiratorias | 7 (33,3%) | 20 (71%) | 6 (75%) | 4 (66%) | 2 (33%) | 3 (50%) |
| NB | 4 (19%) | 13 (46%) | 3 (37,5%) | 2 (33%) | 1 (17%) | 1 (17%) |
| Empiema | 3 (14,2%) | 7 (25%) | 3 (37,5%) | 2 (33%) | 1 (17%) | 2 (33%) |
| BP | 7 (33,3%) | 8 (28,5%) | 1 (12,5%) | 0 (0%) | 4 (66%) | 2 (33%) |
| Mastoiditis | 2 (9,5%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Artritis | 0 (0%) | 0 (0%) | 0 (0%) | 2 (33%) | 0 (0%) | 0 (0%) |
| Ingreso | 14 (66,6%) | 24 (88%) | 6 (75%) | 4 (66%) | 6 (100%) | 6 (100%) |
| UCIP | 7 (33,3%) | 7 (28%) | 4 (50%) | 1 (17%) | 1 (17%) | 1 (17%) |
| Complicaciones | 8 (38%) | 9 (32%) | 5 (62%) | 2 (33%) | 2 (33%) | 3 (50%) |
BP: bacteriemia primaria; NB: neumonía bacteriémica; R: resistencia; ST: serotipo.
En relación con la resistencia antibiótica solo 17 casos de los SNV (17%) presentaron una CMI>0,12μg/l frente a penicilina, siendo fundamentalmente producidos por el serotipo 19A (13 casos; 76%), y en menor medida por los serotipos 15A, 15B, 15C, 35B (4 casos; 24%). La resistencia antibiótica de los principales SNV se refleja en la tabla 3.
Resistencia antibiótica de los principales serotipos emergentes (SNV)
| ST19A 21 (14%) | ST 1 28 (18,7%) | ST 5 8 (5,2%) | ST 3 6 (3,9%) | ST 7F 6 (3,9%) | ST 6A 6 (3,9%) | |
| Infecciones extra-meníngeas | 16 (76%) | 28 (100%) | 7 (87,5%) | 6 (100%) | 6 (100%) | 5 (83%) |
| Penicilina | ||||||
| CMI ≤0,06 | 6 (38%) | 28 (100%) | 7 (100%) | 6 (100%) | 6 (100%) | 5 (100%) |
| CMI 0,12- 1 | 8 (50%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| CMI ≥2 | 2 (12%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Cefotaxima (CMI ≥2) | 2 (12%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Meningitis | 5 (24%) | 0 (0%) | 1 (12,5%) | 0 (0%) | 0 (0%) | 1 (17%) |
| Penicilina | ||||||
| CMI ≤ 0,06 | 2 (40%) | 0 (0%) | 1 (100%) | 0 (0%) | 0 (0%) | 1 (100%) |
| CMI 0,12- 1 | 3 (60%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| CMI ≥2 | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Cefotaxima (CMI ≥1) | 3 (60%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Eritromicina (CMI ≥0,5) | 16 (76,1%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 3 (50%) |
| Multirresistencia (≥3 atb) | 2 (9,5%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
El principal serotipo emergente fue el serotipo 19A (21 aislamientos; 14%). El serotipo 19A se caracterizó por ser el principal productor de meningitis, así como de empiema pleural, bacteriemia y mastoiditis (tabla 2). Asimismo, resalta como el principal serotipo emergente que asocia altos niveles de resistencia a penicilina (61,5%). Debido a su gran repercusión epidemiológica y clínica el serotipo 19A ha sido analizado de forma separada.
El serotipo 1 fue el que se aisló con más frecuencia de forma global (28 aislamientos, 18,7%), siendo la mayoría de los aislamientos en P2 y P3, aunque ya se detectaba en P1. Este serotipo produjo enfermedad respiratoria (71%), fundamentalmente. Todos los aislamientos fueron sensibles a penicilina y cefotaxima.
El serotipo 5 se aisló en 8 casos (5,2%), produciéndose todos los aislamientos en una onda epidémica entre los años 2005-2008. Produjo, fundamentalmente, infecciones respiratorias (75%), tanto neumonía como empiema pleural. Todos los aislamientos fueron sensibles a penicilina y cefotaxima.
El serotipo 3 se aisló en 6 casos (3,9%), siendo la mayoría de los aislamientos en P2 y P3. Este serotipo produjo un espectro clínico similar a los serotipos 1 y 5, especialmente infección respiratoria, aunque se aisló en 2 casos de artritis séptica. Todos los aislamientos fueron, igualmente, sensibles a penicilina y cefotaxima.
El serotipo 7F, que se empezó a serotipar a partir del año 2006, produjo 6 casos de ENI (3,9%), siendo productor, fundamentalmente, de bacteriemia primaria (66%). Todos los aislamientos fueron sensibles a penicilina y cefotaxima.
El serotipo 6A se aisló en 6 pacientes, principalmente en P1 y P2, con una disminución en P3. Este serotipo produjo, sobre todo, enfermedad respiratoria, además de un caso de meningitis. Fue un serotipo sensible a penicilina y cefotaxima.
Serotipos no vacunables no incluidos en ninguna vacuna comercializada hasta la fechaUn total de 25 casos de ENI (16,1%) fueron producidos por SNV no incluidos en ninguna vacuna actualmente comercializada. En este sentido, cabe destacar el papel del serotipo 15C (5 casos; 3,2%), que afectó con más frecuencia a mayores de 2 años (60%). Este serotipo produjo, fundamentalmente, enfermedad respiratoria (60%) y bacteriemia primaria (40%). El 80% de los aislamientos fueron sensibles a penicilina, y todos a cefotaxima. Otros serotipos destacados fueron: 15A (un caso); 15B (2 casos), que produjo un caso de meningitis; el serotipo 35B (2 casos), que produjo 2 casos de meningitis en P3 y el serotipo 38 (2 casos), que produjo un caso de meningitis y uno de neumonía bacteriémica. El resto de serotipos emergentes fueron: el serogrupo 7 y los serotipos 10A, 21, 24, 28, 31, 33. Hubo 5 aislamientos de SP que no pudieron tiparse (3,2%).
DiscusiónLa introducción de la VNC7 produjo una disminución de los serotipos incluidos en la misma o SV, que se objetivó prácticamente a nivel mundial, como se demuestra en múltiples estudios1,2. El incremento posterior de la incidencia de SNV ha sido variable de unas zonas a otras. Mientras en algunos lugares, fundamentalmente en EE. UU., se objetivó un menor incremento de los SNV10, en la mayor parte del territorio mundial, así como en España, este incremento fue más significativo3.
Inicialmente, tras la introducción de la VNC7, no se objetivó en nuestra cohorte un aumento de los SNV. De este modo, la incidencia de SNV en P1 fue de 13,4 casos por 100.000 niños, manteniéndose en 10,3 casos en P2. Sin embargo, al analizar años posteriores (P3), podemos observar un aumento muy marcado de la incidencia de los SNV, hasta 28,3 casos por 100.000 niños, lo que produjo un incremento en la incidencia global de ENI. Este hecho es debido, probablemente, a que los cambios en el fenómeno de reemplazo precisan de un tiempo de instauración suficiente para que se recolonice la vía respiratoria por los nuevos serotipos emergentes. Afortunadamante, una gran parte de estos SNV cuya incidencia aumentó en P3 se encuentran incluidos en las vacunas antineumocócicas ampliadas, como la VNC10 y VNC13, pero, por otro lado, indican que la prevención de la ENI a través de vacunas de serotipos podría perder efectividad con el tiempo al inducir un reemplazo progresivo de los serotipos que producen ENI.
Los principales serotipos emergentes en nuestro trabajo durante los últimos años (P3) fueron: 19A, 1, 5, 3, 7F y 15C. Algunos estudios realizados en España han demostrado un incremento de los SNV, con especial incremento del serotipo 19A3,11–13. En un estudio prospectivo realizado en Barcelona hasta el año 2006 se demostró que en el último periodo el porcentaje de SNV ascendía al 78%, mientras que en el periodo prevacunal era del 28%, siendo los serotipos más frecuentes en época posvacunal el 19A, 1, 7F, 5 y 33. Sin embargo, otros autores no han observado cambios relevantes en la distribución de serotipos14,15.
En Francia también se observó un incremento de SNV desde 9,4 a 17,5 casos por 100.0000 niños hasta el año 200616, siendo los SNV más frecuentes el 19A, 7F, 3, 1, 22F, 24F, 10A, 15C y 33F. A nivel europeo los serotipos más emergentes han sido el 1, 19A, 3, 6A y 7F4.
Estudios estadounidenses demostraron un incremento de SNV como causantes de ENI de hasta un 37% a partir del segundo año de vacunación, destacando el serotipo 19A, así como los serotipos 3, 15, 22F y 33F17–19. A pesar de que la emergencia de SNV tras la introducción de VNC7 se demuestra en múltiples estudios17,20–24, algunos estudios poblacionales de EE. UU. de más de 20 millones de habitantes objetivan una disminución en la incidencia de ENI producida por SV hasta de un 97%, pero con un escaso aumento de SNV de menos del 20%21. En otros trabajos, fundamentalmente también en EE. UU., no se evidencia un incremento de los SNV hasta el año 2007, sin objetivar tampoco incremento en la incidencia global de ENI10. Estos trabajos intentan buscar otros factores que puedan justificar las diferencias de unas regiones a otras, tanto en la disminución de SV como en el aumento de los SNV, como el uso racional de antibióticos, la sensibilidad antibiótica de los serotipos circulantes o la exposición al humo de tabaco, entre otros25, lo que pone de manifiesto, una vez más, la importancia de estudios individualizados de campo para poder caracterizar con exactitud la ENI.
Al analizar los diferentes serotipos emergentes en nuestro estudio podemos destacar:
El serotipo 1 es el principal implicado en el incremento de la incidencia de empiema pleural en P3. Varios autores habían observado un aumento en la incidencia de este serotipo en los últimos años de hasta un 11% en el periodo 2005-200726, demostrando unas características epidémicas similares a otros serotipos, como el 5. El aumento de la incidencia de empiema pleural, fundamentalmente en niños mayores de 2 años, ya se documenta en varios estudios nacionales27 e internacionales28, siendo el agente etiológico de la neumonía neumocócica hasta en el 80% de los casos, fundamentalmente tras la introducción de la VNC729. Todos los aislamientos detectados en nuestro trabajo fueron sensibles a penicilina, como se viene reflejando en otros trabajos30. Por ello, parece razonable continuar recomendando penicilina y derivados para el tratamiento, tanto de la neumonía neumocócica, como del empiema pleural.
El serotipo 5 presentó una onda epidémica entre los años 2005-2008, sin detectarse ningún caso fuera de ese periodo, lo que indica que es un serotipo con una importante variación epidémica31. Produjo, fundamentalmente, neumonía, siendo un serotipo siempre sensible a penicilina en nuestro trabajo. Este serotipo se ha descrito sobre todo en adultos, principalmente en mayores de 65 años, estando implicado en algunas series hasta en un 15% de los casos de ENI26.
El serotipo 3 es un importante causante de enfermedad respiratoria, produciendo, además, 2 casos de artritis séptica en nuestra serie. Diversas publicaciones describen este serotipo como un importante patógeno a nivel respiratorio, produciendo neumonía hasta en el 53% de los casos de ENI en los que está implicado. Con mucha frecuencia produce neumonía necrotizante complicada32, hasta en un 79% de los casos en algunas series29. Es un serotipo que afecta con más frecuencia a niños mayores y adultos, siendo, en general, un serotipo sensible a antibióticos33.
El serogrupo 7, y en concreto el serotipo 7F, ha cobrado cierto protagonismo en la época posvacunal, siendo un importante causante de bacteriemia primaria en menores de 2 años, al igual que se objetivó en nuestro estudio. Algunos estudios españoles, como un realizado en la región de Navarra, describen el aumento de este serotipo34. Otros trabajos europeos en Francia, Portugal e Inglaterra, así como en EE. UU., también destacan este serotipo dentro de los principales causantes de ENI en la era de la VNC7, con gran heterogeneidad en las infecciones que produce16,35,36.
El serotipo 6A, que ya se aislaba en la época prevacunal, ha disminuido tras la introducción de la VNC7, probablemente por la protección cruzada con el serotipo 6B. Produjo desde infecciones respiratorias hasta bacteriemia primaria, causando un caso de meningitis en nuestro trabajo.
Cabe destacar la emergencia de otros serotipos, fundamentalmente en los últimos años, como el serogrupo 15 (15A, 15B y 15C) y los serotipos 10A, 24, 31, 33, 35B, 38, 33, que podríamos denominar como los «nuevos serotipos emergentes», ya que aparentemente su incidencia está en ascenso y no se encuentran incluidos en las vacunas ampliadas, por lo que su vigilancia epidemiológica será fundamental en el futuro. Algunos estudios multicéntricos en EE. UU. detectan que estos serotipos se encuentran en expansión, con algunos casos de resistencia a penicilina, fundamentalmente en el serogrupo 1524,37. No detectamos en nuestro trabajo ningún aislamiento de otros serotipos descritos en otros trabajos internacionales como los serotipos 6C, 8,11A, 12F, 16F, 22F y 33F21,37–39.
Teniendo en cuenta el importante incremento en la incidencia de ENI causada por estos SNV, la mayor parte de ellos incluidos en las nuevas vacunas antineumocócicas ampliadas, parece obvio que la inclusión de estas vacunas dentro de los calendarios sistemáticos de vacunación podría suponer un incremento significativo de la prevención de ENI, siendo de un 49% para VNC10 y de un 78% para VNC13 en P3, según nuestra serie. Estos resultados son similares a otros estudios europeos donde los SNV incluidos en la VNC13 ascienden al 80%5.
Podemos concluir que en nuestro estudio ha existido un claro incremento de la ENI producida por SNV, coincidiendo con la introducción de la VCN7, destacando las infecciones respiratorias de vías bajas producidas por los serotipos 1, 5 y 3, y los cuadros de meningitis producidos por el serotipo 19A. Cabe recalcar que la mayoría de los serotipos, con la excepción del 19A, son sensibles a penicilina, lo que podría tener importantes implicaciones en el diagnóstico y tratamiento de estas infecciones. Consideramos de enorme importancia el conocimiento de la epidemiología de la ENI en las diferentes zonas geográficas, ya que, de este modo, se podrá tener un verdadero criterio a la hora de valorar la inclusión sistemática de las vacunas antineumocócicas ampliadas dentro de los territorios donde no se encuentran incluidas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Servicio de Microbiología, ya que su ayuda y sus datos microbiológicos han sido la base para la realización de este trabajo.