El timoma maligno es una neoplasia rara en sujetos pediátricos y generalmente se asocia con síndromes paraneoplásicos; el más típico es la miastenia grave. También se describen alteraciones hematológicas, como la aplasia pura de serie roja o la aplasia medular completa. A continuación se presenta el caso de un varón de 12 años con un timoma maligno de gran tamaño tratado con poliquimioterapia. El sujeto desarrolló una aplasia medular grave después de la cirugía, con mala respuesta al tratamiento inmunosupresor, que evolucionó a hemorragia pulmonar masiva.
Malignant thymoma is a very rare neoplasm in paediatric patients; it is usually associated with para-neoplastic syndromes, the most frequent is myasthenia gravis; some haematological abnormalities may also be present, such as pure red cell aplasia or aplastic anaemia. We report a 12-year-old boy suffering from a very large thymoma, treated with multiple chemotherapy, and who developed a severe aplastic anaemia after surgery. He had a poor response to immunosuppressive treatment and later developed massive pulmonary bleeding as a complication.
El timoma maligno es una neoplasia muy poco frecuente en la infancia. En general, tiene un patrón de crecimiento local lento y, en ocasiones, el diagnóstico de la enfermedad se hace de forma casual al practicar una radiografía de tórax por otro motivo. Clásicamente se asocia con miastenia grave y con otros síndromes paraneoplásicos, como la aplasia pura de células rojas. En algunos casos, se describe la aplasia medular completa mediada por mecanismo inmune.
A continuación se presenta el caso de un niño con diagnóstico de timoma que en la evolución asoció aplasia medular grave.
Caso clínicoVarón de 12 años y 8 meses, de raza árabe, que realizó una consulta por presentar clínica de 48h de evolución, con dolor torácico izquierdo y dificultad respiratoria moderada. El mes anterior había presentado astenia, anorexia, disnea de esfuerzo y tos. Sus antecedentes personales eran los siguientes: período neonatal y primera infancia sin incidencias; vacunación hasta el 9.° mes de vida; hepatitis a los 10 años que precisó ingreso hospitalario en Marruecos. No se aportaron más datos acerca de la historia. Sus antecedentes familiares no poseían interés clínico.
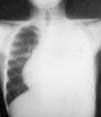
A su ingreso presentaba un estado general conservado, con palidez cutáneomucosa. No presentaba distrés ni asimetría torácica. La auscultación cardiorrespiratoria reveló desplazamiento de los tonos al hemitórax derecho, puros y rítmicos, e hipoventilación del tercio inferior del hemitórax izquierdo. El abdomen era blando y depresible, con esplenomegalia de 3 a 4cm. El resto era normal.
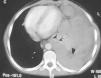
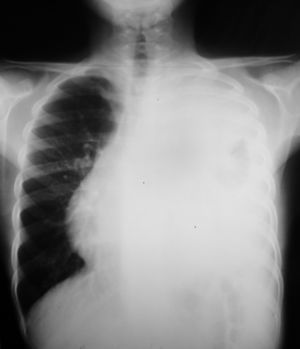
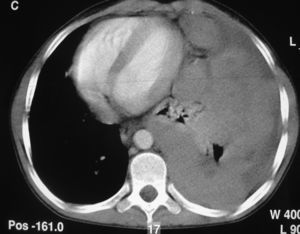
Las pruebas complementarias realizadas determinaron la existencia de una masa de gran tamaño en el mediastino anterior izquierdo, con un desplazamiento de las estructuras vecinas y un colapso casi completo del pulmón izquierdo (figs. 1 y 2).
Tomografía computarizada de tórax con contraste: hemitórax izquierdo de mayor tamaño que el derecho, ocupado por una masa que cruza la línea media en el espacio retoresternal y desplaza los grandes vasos, el corazón y la aorta, descendente hacia el hemitórax derecho. Rodea al pulmón izquierdo, que se ve colapsado en la parte media del hemitórax.
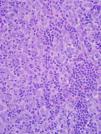
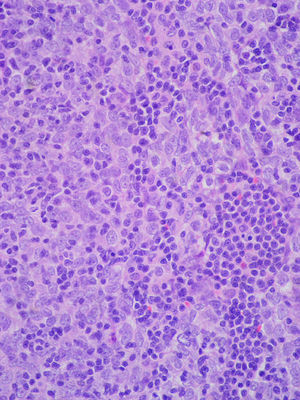
Ante la sospecha de un proceso tumoral maligno, se realizó una biopsia a través de toracotomía, y se llegó al diagnóstico anatomopatológico de timoma maligno trabecular (fig. 3). Se realizó un estudio de extensión que reveló médula ósea normal, y una ecografía abdominal que mostró pequeñas adenopatías perihepáticas y peripancreáticas, y esplenomegalia de 12cm.
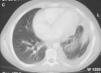
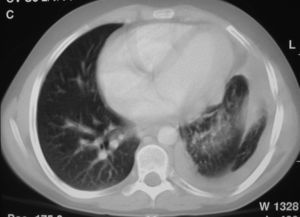
En ese momento, el tumor se consideró irresecable debido a su extensión y a su proximidad a los órganos vitales, por lo que recibió un tratamiento quimioterápico con ciclofosfamida (500mg/m2/día 1), adriamicina (25mg/m2/días 1 y 2) y cisplatino (25mg/m2/día D1 y D2) durante 7 ciclos. Con este tratamiento, se consiguió la disminución del tamaño tumoral (fig. 4).
Posteriormente se realizó una extirpación parcial del tumor. La intervención quirúrgica fue dificultosa debido a que el timoma se había infiltrado en la língula y en el lóbulo pulmonar inferior izquierdo. Durante la cirugía se produjo una hemorragia profusa.
A las 48h de la intervención, la cifra de plaquetas del paciente experimentó un descenso progresivo, que coincidió con un proceso febril, sin que se constatara etiología infecciosa. Se asoció con una anemización progresiva, con serie blanca normal.
Pasados 7 días de la cirugía, el paciente presentó un cuadro de dificultad respiratoria intensa y progresiva, dolor torácico marcado, desaturación y esputos hemoptoicos, por lo que se necesitó intubación y conexión a ventilación mecánica durante 6 días. La radiografía de tórax mostró un patrón alveolar de hemorragia pulmonar. Se administraron múltiples transfusiones de plaquetas y hematíes, y se consiguió la mejoría clínica progresiva del sujeto. Ante la sospecha de citopenia de origen autoinmune en relación con el timoma, se inició un tratamiento empírico con gammaglobulina (3mg/kg/dosis cada 12h durante 7 días) y metilprednisolona (1,5mg/kg/día durante 11 días) y su posterior reducción progresiva. El sujeto no experimentó mejoría analítica, ya que continuaba precisando frecuentes transfusiones de plaquetas.
A continuación se amplió el estudio del sujeto a través de un aspirado y una biopsia de médula ósea, en los que se encontró una hipocelularidad intensa, compatible con aplasia medular grave. Además, se realizó un estudio de los marcadores inmunológicos de las subpoblaciones linfocitarias, que resultó normal.
Se añadió al tratamiento ciclosporina A como inmunosupresor (3mg/kg/dosis cada 12h), con control estricto de la función renal y las concentraciones séricas del fármaco.
Seis días más tarde, el sujeto presentó un empeoramiento clínico con fiebre, dolor costal, disnea, hipoxemia, taquicardia y hemoptisis. Estos síntomas coincidieron con un recuento plaquetario en 5.000/μm3. Se confirmó radiológicamente la presencia de una nueva hemorragia pulmonar y el sujeto precisó ingresar en la unidad de cuidados agresivos pediátricos con intubación y ventilación mecánica con parámetros intensivos, asoció repercusión hemodinámica, por lo que recibió expansión de volumen, hemoderivados y fármacos vasoactivos. Finalmente, el sujeto falleció tras una arritmia cardíaca que no respondió a las medidas de reanimación cardiopulmonar avanzada.
DiscusiónEl timoma es una neoplasia epitelial que se origina en la glándula tímica. La mayoría de los timomas tienen un comportamiento histológico benigno, con un curso indolente y una supervivencia prolongada. Algunos casos tienen un comportamiento más agresivo, con invasión local (pleura o pulmón) y metástasis a distancia.
La edad más frecuente de presentación es la edad adulta, entre la cuarta y la sexta décadas de vida, sin predilección por ningún sexo. En los niños es extremadamente raro.
Aproximadamente la mitad de los casos de timoma se diagnostican casualmente1, ya que cursan de forma asintomática. La clínica más frecuente que pueden presentar estos sujetos es dolor torácico, tos, disnea, disfagia, infecciones de vía aérea inferior y síndrome de vena cava superior.
El sistema de estadificación de Masaoka2, clasifica los timomas desde el punto de vista postoperatorio en base a la invasión capsular. Así, el estadio I engloba los tumores no invasivos; el estadio II, los mínimamente invasivos; el estadio III, los extensamente invasivos localmente (pericardio, grandes vasos o pulmones) y el estadio IV, los metastásicos.
El tratamiento de elección en los casos de enfermedad local (estadios I y II) es el quirúrgico3. La resección incompleta ensombrece el pronóstico, con un riesgo de recurrencia local del 28%4.
El timoma es un tumor radiosensible, por lo que la radioterapia desempeña un papel importante en su tratamiento local. Se puede emplear como tratamiento adyuvante postoperatorio en el estadio II (aunque hay controversia1,3,5 al respecto), III y IV. No parece mejorar la supervivencia en el estadio I. También está indicado como agente único inicial en los timomas irresecables o como tratamiento de rescate en recaídas.
Los regímenes poliquimioterápicos empleados con mayor tasa de respuesta global y de supervivencia en los estadios invasivos son los que combinan adriamicina y cisplatino3.
Frecuentemente se describen síndromes paraneoplásicos asociados a los timomas; el más frecuente es la miastenia grave, que está presente en el 30% de los timomas. Además, en el 15% de las miastenias graves hay un timoma. Este síndrome es más típico en los adultos, aunque también se ha descrito en pediatría6.
Igualmente se ha descrito la aparición de otras enfermedades asociadas al timoma, con un claro origen autoinmune, como la artritis reumatoide, la tiroiditis, la alopecia areata, el lupus eritematoso sistémico y la colitis ulcerosa.
La afectación medular que pueden presentar los sujetos con timoma es variada: desde la aplasia pura de células rojas7, clásicamente asociadas, hasta la agranulocitosis8, la hipoplasia megacariocítica9 e incluso la aplasia medular completa10, como la que presentó este sujeto. Se supone que un mecanismo inmunitario media estas alteraciones a través de los linfocitos T que libera el timo, ya que en general la respuesta con el tratamiento inmunosupresor (corticoesteroides, ciclosporina A, globulina antitimocito) es favorable. En algunos casos se han descrito cifras elevadas de linfocitos CD8+ en la sangre periférica y en la médula ósea de los sujetos afectados11.
En el caso de este sujeto, a pesar de comenzar de forma precoz el tratamiento inmunosupresor, la evolución fue desfavorable y presentó una complicación grave, como es la hemorragia pulmonar masiva.
La médula ósea del sujeto antes de la cirugía era normal y, sin embargo, la citopenia apareció pocos días después de la intervención. Esto hace pensar que, tras la manipulación de la glándula, pudo haberse desencadenado un mecanismo de liberación de células, que actuaron de forma autoinmune frente a los progenitores hematopoyéticos, por lo que el sujeto desarrolló esta aplasia medular.