la asociación de trastornos tiroideos y enfermedades autoinmunitarias ha sido descrita en adultos y, en menos ocasiones, en niños. El objetivo de este trabajo es analizar la prevalencia y las características de las alteraciones tiroideas en niños con enfermedades reumáticas.
Pacientes y métodose estudió a 145 pacientes (109 mujeres y 36 varones) atendidos en una unidad de reumatología pediátrica durante 2 años. Los diagnósticos fueron: artritis idiopática juvenil (AIJ) (n=115), lupus (n=17), dermatomiositis juvenil (n=5), esclerodermia (n=4) y 1 caso de cada uno de los siguientes: enfermedad mixta del tejido conectivo, síndrome CINCA (chronic infantile neurologic cutaneous and articular), TRAPS (tumor necrosis factor receptor-associated periodic syndrome) y fiebre mediterránea familiar. En todos se determinaron las concentraciones de T4 y TSH, y si estaban alterados, se determinaban los anticuerpos antitiroideos (ATA).
Resultados6 niñas tuvieron alteración tiroidea, con edades de 2 a 17 años; 3 tenían AIJ y 3, lupus; 5 fueron diagnosticadas de hipotiroidismo autoinmunitario, con ATA elevados, y 1 caso, de hipertiroidismo. El 100% de los pacientes con alteración tiroidea tenían anticuerpos antinucleares (ANA) positivos, frente al 37,4% de los restantes (p=0,003).
ConclusionesLa prevalencia de alteraciones tiroideas en niños con enfermedad reumática fue del 4,14%, y aumentó al 7,9% en AIJ con ANA positivos y al 17,6% en lupus. La mayoría estaban asintomáticos. La determinación de hormonas tiroideas debería realizarse al diagnóstico de enfermedad reumática y de forma periódica después.
The relationship between thyroid dysfunction and autoimmune diseases has mainly been described in adults. The aim of this study was to analyse the prevalence and characteristics of thyroid abnormalities in children with rheumatic diseases.
Patients and methodOne hundred and forty-five patients (109 girls and 36 boys) from a rheumatology paediatric unit were studied for two years. The diagnoses were: juvenile idiopathic arthritis (JIA) (n=115), lupus (n=17), juvenile dermatomyositis (n=5), scleroderma (n=4), and one case each of the following: mixed connective mixed disease, CINCA syndrome (chronic infantile neurological, cutaneous and articular), TRAPS (tumour necrosis factor receptor-associated periodic syndrome), and familial mediterranean fever. T4 and TSH levels were carried out, and if these showed abnormalities, antithyroid antibodies (ATA) were determined.
ResultsSix girls aged between 2 and 17 years old had thyroid abnormalities. Three had JIA and three had lupus. Five were diagnosed with autoimmune hypothyroidism, with high ATA levels, and there was one case of hyperthyroidism. All of the patients with thyroid dysfunction had positive antinuclear antibodies (ANA), compared to 34.5% of the rest of the patients (p=0.003).
ConclusionsThe prevalence of thyroid abnormalities in children with rheumatic disease was 4.14% to 7.9% in JIA patients with positive ANA, and up to 17.6% with lupus. The majority of patients were asymptomatic. Thyroid hormones should be determined when rheumatic disease is diagnosed and periodically afterwards.
La presencia de alteraciones tiroideas, sobre todo hipotiroidismo e hipertiroidismo autoinmunitario, en enfermedades reumáticas ha sido descrita en adultos1–3, especialmente en lupus eritematoso sistémico (LES)4–6. Algunos estudios también hacen referencia a una posible asociación de estas afecciones en la infancia7–13. El objetivo de este trabajo es analizar la prevalencia y las características de los trastornos tiroideos en niños con enfermedades reumáticas.
Pacientes y métodoSe realizó un estudio transversal durante 2 años (mayo de 2005 a abril de 2007) en una unidad de reumatología pediátrica de un hospital terciario. Todos los padres dieron su consentimiento. Se incluyó a 145 pacientes con enfermedad reumática (109 mujeres y 36 varones). La media de edad fue 10±5 (intervalo, 1,3–20) años. Los diagnósticos fueron: artritis idiopática juvenil (AIJ), 115; lupus, 17; dermatomiositis juvenil, 5; esclerodermia, 4, y 1 caso de cada uno de los siguientes: enfermedad mixta del tejido conectivo, síndrome CINCA (chronic infantile neurologic cutaneous and articular), TRAPS (tumor necrosis factor receptor-associated periodic syndrome) y fiebre mediterránea familiar. Los criterios utilizados para el diagnóstico de AIJ fueron los propuestos por la International League of Associations for Rehumatology (ILAR)14; para el de lupus eritematoso sistémico, los del American College of Rheumatology15, y los de Bohan y Peter para la dermatomiositis16. En todos los casos se determinó la concentración sanguínea de tiroxina libre (T4) y tirotropina (TSH), cuando estos valores estaban alterados, el examen fue repetido para su confirmación y se determinaron los de anticuerpos antitiroideos (ATA): antitiroglobulina (anti-TGB) y antiperoxidasa (anti-PO). Se consideró hipotiroidismo si la T4 estaba baja y/o la TSH estaba aumentada, y el hallazgo de ATA definió el carácter de autoinmunitario. Los datos se analizaron con el programa SPSS versión 11.0 mediante el test exacto de Fisher, y se consideró significativo si p<0,05.
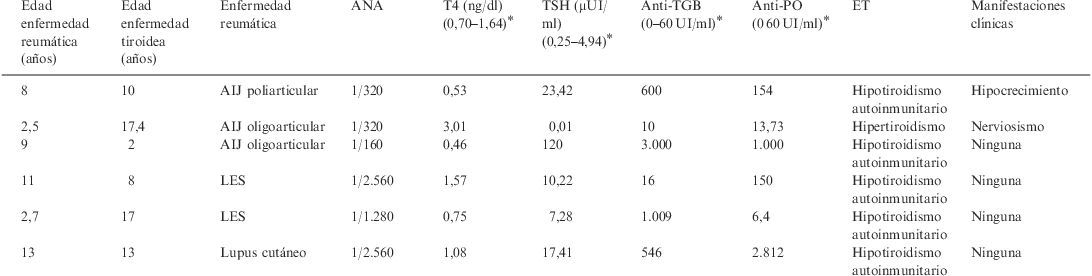
ResultadosSe encontró con alteración tiroidea a 6 niñas con edades entre 2 y 17 años (tabla 1); 3 tenían AIJ (2 oligoartritis y 1 poliartritis sin factor reumatoide) y las otras 3, lupus (2 lupus eritematoso sistémico y 1 lupus cutáneo subagudo); 5 fueron diagnosticadas de hipotiroidismo autoinmunitario y en todas los ATA estuvieron elevados (anti-TGB, anti-PO o ambos). Otra paciente fue diagnosticada de hipertiroidismo, sin encontrarse elevados los anticuerpos antitiroideos y con cifras de inmunoglobulina tiroestimulante (TSI) normales. En ningún caso había otra causa que justificase el aumento de TSH. Dos pacientes tenían antecedentes familiares de enfermedad tiroidea, hipotiroidismo sin más datos en la madre de una niña y adenoma tiroideo intervenido en la de otra. Una de las niñas fue diagnosticada de la alteración tiroidea 5 meses antes del comienzo de la artritis, y en las restantes el tiempo transcurrido entre el diagnóstico de enfermedad reumática y el de la tiroidea varió entre 1 mes y 15 años. Cuatro estaban asintomáticas, por lo que se catalogaron como hipotiroidismo autoinmunitario subclínico; 1 presentaba retraso del crecimiento y la paciente con hipertiroidismo manifestaba ligero nerviosismo. En ningún caso se encontró aumento de la glándula tiroides en la exploración física. Se realizó ecografía en 3 pacientes, que mostraron ligero aumento del tamaño en 2 casos y aumento de la vascularización en los 3. Las 5 niñas diagnosticadas de hipotiroidismo recibieron tratamiento con levotiroxina; en la que tenía hipocrecimiento se normalizó la curva estatural. Todas continúan con tratamiento tras 2 a 7 (media, 3,6) años de evolución. La paciente con hipertiroidismo fue tratada con propranolol, que normalizó las hormonas tiroideas en 3 meses, tras lo que se suspendió la medicación. Los ANA fueron positivos en el 100% de los casos con alteración tiroidea, frente al 37,4% en el resto de los pacientes (p=0,003) y el 31,3% considerando sólo a los pacientes con AIJ (p=0,034). Según este estudio, la prevalencia de alteraciones tiroideas en niños con enfermedad reumática es del 4,14%, y aumenta al 7,9% en AIJ con ANA positivos y al 17,6% en lupus. Una de las niñas con hipotiroidismo autoinmunitario y AIJ también tenía diabetes mellitus tipo 1.
Características de las pacientes con enfermedad reumática y tiroidea
| Edad enfermedad reumática (años) | Edad enfermedad tiroidea (años) | Enfermedad reumática | ANA | T4 (ng/dl) (0,70–1,64)* | TSH (μUI/ml) (0,25–4,94)* | Anti-TGB (0–60UI/ml)* | Anti-PO (060UI/ml)* | ET | Manifestaciones clínicas |
| 8 | 10 | AIJ poliarticular | 1/320 | 0,53 | 23,42 | 600 | 154 | Hipotiroidismo autoinmunitario | Hipocrecimiento |
| 2,5 | 17,4 | AIJ oligoarticular | 1/320 | 3,01 | 0,01 | 10 | 13,73 | Hipertiroidismo | Nerviosismo |
| 9 | 2 | AIJ oligoarticular | 1/160 | 0,46 | 120 | 3.000 | 1.000 | Hipotiroidismo autoinmunitario | Ninguna |
| 11 | 8 | LES | 1/2.560 | 1,57 | 10,22 | 16 | 150 | Hipotiroidismo autoinmunitario | Ninguna |
| 2,7 | 17 | LES | 1/1.280 | 0,75 | 7,28 | 1.009 | 6,4 | Hipotiroidismo autoinmunitario | Ninguna |
| 13 | 13 | Lupus cutáneo | 1/2.560 | 1,08 | 17,41 | 546 | 2.812 | Hipotiroidismo autoinmunitario | Ninguna |
AIJ: artritis idiopática juvenil; ANA: anticuerpos antinucleares; Anti-PO: anticuerpos antiperoxidásicos; Anti-TGB: anticuerpos antitiroglobulínicos; ET: enfermedad tiroidea; LES: lupus eritematoso sistémico; T4: tiroxina libre; TSH: tirotropina.
La prevalencia de alteración tiroidea (hipotiroidismo e hipertiroidismo) en adultos con enfermedades reumáticas autoinmunitarias publicada es del 8,2%1. En pacientes con LES, este porcentaje puede ser más alto; así, Miller et al6, en un estudio realizado en 332 adultos diagnosticados de LES, encontraron que el 39% tenía cifras elevadas de TSH con hormonas tiroideas normales (hipotiroidismo subclínico), y el 5%, alteración hormonal (hipotiroidismo bioquímico). Según otro estudio, la alteración hormonal y la presencia de anticuerpos antitiroideos es mayor si el LES está activo5.
Los estudios realizados en niños con AIJ muestran una prevalencia de hipotiroidismo autoinmunitario entre el 9,3 y el 12%7,10, mientras es<3% en los controles10. Al igual que en adultos, la frecuencia aumenta en los casos con LES, como en la serie de Eberhard et al8, en la que encuentran alteración tiroidea en 6 de 35 estudiados (17%). En el presente estudio la prevalencia de enfermedad tiroidea en el total de pacientes con enfermedad reumática fue del 4,14%; este porcentaje aumentó hasta el 7,9% en niños con AIJ y ANA positivos y al 17,6% en los casos de lupus. Se encontró una asociación entre enfermedad tiroidea y presencia de ANA, lo cual no ha sido referido específicamente en otras series. Tal como se ha publicado en otros estudios, el diagnóstico más frecuente fue de hipotiroidismo subclínico autoinmunitario.
Algunos autores han estudiado la presencia de ATA en enfermedades reumáticas infantiles, y han encontrado un aumento en estudios controlados7,9. Estos anticuerpos no estaban asociados a enfermedad tiroidea clínica ni bioquímica, por lo que el interés de su determinación es escaso si las hormonas tiroideas son normales. En este estudio, los ATA sólo se solicitaron cuando las hormonas tiroideas estaban alteradas, y estaban elevadas en los 5 casos en que se diagnosticó hipotiroidismo.
La asociación de enfermedad reumática con más de una enfermedad autoinmunitaria también ha sido referida por algunos autores4. En este estudio una de las pacientes con AIJ oligoarticular también tenía diabetes mellitus tipo 1.
En resumen, los resultados de este estudio respaldan la conveniencia de determinar las hormonas tiroideas al diagnóstico, y de forma periódica después en niños con enfermedad reumática autoinmunitaria, especialmente si presentan anticuerpos antinucleares positivos.
Este artúculo se presentó previamente como comunicación oral en el VI Congreso Nacional de la Sociedad Española de Reumatología Pediátrica en Santa Cruz de Tenerife, 22 al 24 de noviembre de 2007.