Tras varios años de empleo de eritropoyetina (EPO) en la profilaxis de la anemia del prematuro se empezó a utilizarla en algunos recién nacidos (RN) para tratar la anemia neonatal tardía posthemólisis y evitar la transfusión de hematíes.
ObjetivoMostrar los resultados del tratamiento con EPO en la anemia neonatal tardía posthemólisis.
Pacientes y métodosEstudio observacional en 13 RN con anemia tardía secundaria a enfermedad hemolítica por isoinmunización Rh (9 casos), ABO (2 casos), déficit de glucosa-6-P-deshidrogenasa (1 caso) e idiopática (1 caso). Los neonatos iniciaron el tratamiento con EPO cuando se encontraron en indicación de transfusión o próximo a ella.
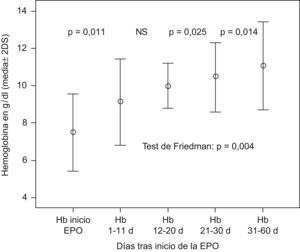
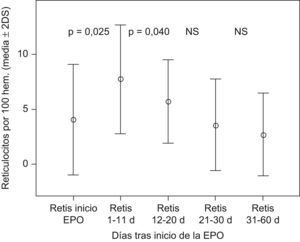
ResultadosSe empezó el tratamiento con EPO a la edad de 26±7 días (15–46), con un valor de hematocrito de 21,7±3% (18–27) y un recuento reticulocitario del 3,8±2,2%. En 11 niños se pudo evitar la transfusión (alcanzaron un hematocrito de 30,7±4,4% y reticulocitos del 5,9±1,4%) y sólo 2 debieron ingresar a tal efecto (con hematocrito 18±1,4% y reticulocitos del 0,6%). Tras la EPO se encuentra un aumento significativo de la hemoglobina (Hb) y de los reticulocitos
ConclusionesLa EPO se ha mostrado útil para evitar la transfusión de hematíes en el 84% de los niños tratados. No se han observado efectos secundarios atribuibles a su uso.
After several years of erythropoietin (EPO) use in the prophylaxis of anaemia of prematurity, it also began to be administered to treat post-haemolytic disease anaemia of the newborn in order to avoid blood transfusions.
ObjectiveTo show the results obtained with EPO treatment in post-haemolytic disease anemia of the newborn.
Patients and methodsObservational study in 13 newborns with late anaemia due to an hemolytic disease caused by Rh isoimmunization (9 cases), AB0 isoimmunization (2 cases), glucose-6-P-dehydrogenase deficiency (1 case) or idiopathic (1 case). The newborns began EPO treatment when they reached the haematocrit level for a blood transfusion.
ResultsEPO treatment was started at 26±7 days of life (15–46), with a haematocrit value of 21.7±3% (18–27) and a reticulocyte count of 3.8±2.2%. Blood transfusion was not necessary in 11 newborns (haematocrit of 30.7±4.4% and reticulocytes of 5.9±1.4%), and only 2 newborns were admitted for a blood transfusion (haematocrit 18±4.4% and reticulocytes 0.6%). Significant increases in haemoglobin and reticulocyte figures were seen after EPO treatment.
ConclusionsEPO administration proved useful to avoid blood transfusion in 84% of treated newborns. No adverse events were detected which could be attributed to this treatment,.
Desde hace años se viene utilizando la eritropoyetina humana recombinante (EPO) junto a otras medidas, como profilaxis de la anemia del prematuro a fin de disminuir o evitar las transfusiones de hematíes1–3. Su uso sigue siendo controvertido, pues aunque disminuye el número de transfusiones no ha conseguido evitarlas por completo en el grupo de prematuros más pequeños4,5, por lo que algunos profesionales no creen que su beneficio sea suficiente frente a los posibles efectos adversos, sobre todo la retinopatía del prematuro6,7. Por otro lado, con la aplicación de protocolos estrictos para las transfusiones, el empleo de varias alícuotas de la misma extracción para disminuir el número de donantes, y una valoración cuidadosa de la necesidad y cuantía de las extracciones sanguíneas para analíticas, se ha disminuido la cantidad de transfusiones de hematíes y su riesgo inherente8,9.
En nuestro Servicio de Neonatología, desde hace más de 1 década, se trata con EPO a los prematuros de muy bajo peso de nacimiento. No se han observado efectos secundarios y su empleo para tal fin ha dado buenos resultados10,11. Basándose en estos resultados y los de Ohls et al con el empleo de EPO en los primeros casos publicados de anemia hemolítica hiporregenerativa12, se incluyó la posibilidad de emplearla en el tratamiento de algunos recién nacidos (RN) con anemia tardía postenfermedad hemolítica para evitarles reingresos para transfusión de hematíes (TH). Una vez superados los problemas iniciales de anemia e ictericia en sus diversos grados y formas de presentación13, los RN con enfermedad hemolítica se enfrentan a un cuadro de anemia de instauración más o menos brusca a partir de la 2.a–6.a semana que, hasta el momento actual, requiere ingreso para su tratamiento mediante transfusiones de hematíes13–15. La respuesta reticulocitaria es insuficiente16,17 y los RN presentan una anemia sintomática grave. También ha podido constatarse que los valores de EPO acostumbran a ser bajos con relación al grado de anemia12,14,15,18. Sin tratamiento, la reactivación espontánea de la eritropoyesis ocurre a partir de los 2–4 meses.
Se presentan 13 casos de RN con anemia tardía postenfermedad hemolítica que fueron tratados con EPO de forma ambulatoria, comentando los resultados obtenidos respecto a la posibilidad de disminuir las hospitalizaciones y transfusiones de hematíes en este grupo de pacientes.
Pacientes y métodosLos 13 RN nacieron entre los años 2003 y 2008, 8 de los cuales eran niñas. Doce precisaron hospitalización durante los primeros días de vida y el restante, afectado de una enfermedad hemolítica por incompatibilidad Rh, ingresó a los 9 días con un cuadro de anemia grave. Se diagnosticó anemia hemolítica en todos los casos. Su etiología fue por isoinmunización Rh en 9, ABO en 2, 1 caso de déficit de glucosa-6-fosfato deshidrogenasa y 1 cuadro hemolítico idiopático. Cuatro de los 9 casos de isoinmunización Rh habían recibido transfusiones intraútero (TIU). La edad gestacional media era de 36,9±2,4 semanas (31–39) y el peso de nacimiento de 2.859,6±520g (1.630–3.730). Durante los primeros días de vida, 11 (84,6%) recibieron fototerapia, 4 además gammaglobulina intravenosa (30,7%) y a 2 se les practicó exanguinotransfusión (15,4%), el 1.er y 3.er días de vida. Cuatro (31%) habían recibido transfusiones antes de iniciar la EPO (un RN recibió 3, y 3 neonatos recibieron 1) (tabla 1).
Características de los recién nacidos afectados de enfermedad hemolítica y tratados con eritropoyetina humana recombinante (EPO)
| Causa | EG | PN (g) | TIU | Sexo | Clínica | Tratamiento | Reingreso para transfusión |
| AB0 | 39 | 3.190 | – | F | Ictericia | Fototerapia | No |
| AB0 | 38 | 3.730 | – | M | Ictericia | Fototerapia | No |
| Rh | 38 | 2.930 | – | F | Ictericia | Fototerapia | No |
| Rh | 39 | 3.220 | – | F | Ictericia | Fototerapia; IgEV | No |
| Rh | 38 | 2.680 | – | M | Ictericia | Fototerapia | No |
| Rh | 38 | 2.720 | – | F | Anemia | Transfusión-3 | No |
| Rh | 39 | 3.175 | – | F | Ictericia | Fototerapia | No |
| Rh | 35 | 2.750 | 3 | M | Ictericia | Fototerapia; IgEV; exanguinotransfusión | Sí |
| Rh | 38 | 3.380 | 3 | M | Anemia | – | Sí |
| Rh | 38 | 2.830 | 3 | F | Ictericia; anemia | Fototerapia; IgEV; transfusión-1 | No |
| Rh | 34 | 2.470 | 3 | F | Ictericia; anemia | Fototerapia; IgEV; exanguinotransfusión; transfusión-1 | No |
| G-6-PD | 31 | 1.630 | – | M | Ictericia | Fototerapia | No |
| Idiopática | 35 | 2.470 | – | F | Ictericia | Fototerapia | No |
AB0: isoinmunización AB0; EG: edad gestacional; F: femenino; G-6-PD: déficit de glucosa-6-fosfato deshidrogenasa; IgEV: inmunoglobulina EV; M: masculino; PN: peso nacimiento; Rh: isoinmunización Rh; TIU: transfusión intrauterina.
Tras el alta pasaron a control ambulatorio para vigilar la posible agravación de su cuadro hematológico. Los resultados de los análisis mostraron anemia intensa, en situación de indicación de TH, pero dado el buen estado general de los niños con curva ponderal ascendente y la ausencia de signos de insuficiencia cardíaca, se ofreció a las familias la posibilidad de ensayar un tratamiento ambulatorio con EPO, advirtiéndoles de la posibilidad de reingreso para TH en el caso de fracaso del tratamiento.
Se administró EPO a dosis de 200–250U/kg, 3 veces por semana durante 3–4 semanas por vía subcutánea. Tras las 3 primeras dosis se practicó el primer análisis para constatar la evolución de los valores sanguíneos. Si se había detenido el descenso, se proseguía el tratamiento hasta que las cifras hematológicas salían de los valores de indicación de transfusión (8–12 dosis en total). Cuando en el primer control no se observaba detención o mejoría de la situación de anemia, se procedía a ingreso para TH. El estudio fue aprobado por el comité de ética de investigación del hospital.
El tratamiento estadístico incluyó la descripción de las variables cuantitativas (media±desviación estándar e intervalo) y cualitativas (porcentaje). También se analizó la evolución de los valores de Hb y reticulocitos tras la administración de EPO, aplicando el test de Friedman para datos apareados a lo largo de toda la evolución, y el test de Wilcoxon para datos apareados para comparar dos puntos consecutivos.
ResultadosEn el momento del inicio del tratamiento con EPO las edades de los recién nacidos eran de 26,46±7,55 días (15–46) y los valores sanguíneos: hematocrito 21,75±3,04% (18–27), Hb 7,4±1,02g/dl (6,2–9,4) y reticulocitos 3,8±2,2% (0,3–8). Se administraron entre 5 y 12 dosis de EPO durante el tratamiento; 2 lo abandonaron por necesidad de ingreso para transfusión tras 5 y 7 dosis, respectivamente; los que lo finalizaron con «éxito» lo hicieron tras 8–12 dosis.
Los 11 RN en que la EPO fue exitosa, al finalizar el tratamiento tenían entre 28 y 59 días. Solo 2 habían recibido TIU. Los 2 RN que no finalizaron el tratamiento y reingresaron para transfusión lo hicieron a los 47 y 60 días. Ambos habían recibido TIU. La tabla 2 muestra la evolución de los valores sanguíneos de ambos grupos.
Características hematológicas de los neonatos afectados de enfermedad hemolítica según la respuesta al tratamiento con eritropoyetina humana recombinante (EPO)
| Ingreso | Inicio EPO | Final EPO | |
| Respuesta positiva (n=11) | |||
| Edad (días) | 1,4±0,8 (1–3) | 24,2±5 (15–34) | 42,5±8,8 (28–59) |
| Hematocrito (%) | 48±7,9 (38–64) | 22,0±2,9 (19–27) | 30,7±4,5 (26–42) |
| Hemoglobina (g/dl) | 14,9±4,4 (10–22,5) | 7,4±1,0 (6,2–9,4) | 10,1±1,0 (8,3–11,5) |
| Reticulocitos (%) | 8,8±3,1 (6,6–11) | 4,1±2,2 (0,6–8) | 5,9±1,4 (3,6–7,8) |
| Respuesta negativa (n=2) | |||
| Edad (días) | 1 | 36 (26–46) | 53,5 (47–60) |
| Hematocrito (%) | 34±11,3 (26–42) | 19,5±2,1 (18–21) | 18,0±1,4 (17–19) |
| Hemoglobina (g/dl) | 11,8±4,0 (9–14,7) | 6,9–0,4 (6,6–7,2) | 5,1±0,5 (4,7–5,5) |
| Reticulocitos (%) | 3,1±3,8 (0,4–5,9) | 0,4±0,2 (0,3–0,5) | 0,6±0,08 (0,6–0,7) |
El estudio estadístico para datos apareados encuentra diferencias significativas, tanto en la elevación de la Hb como en la respuesta reticulocitaria tras el inicio del tratamiento con EPO (figs. 1 y 2).
La anemia tardía por enfermedad hemolítica del RN es frecuente. Al-Alaian et al publican una incidencia del 83% en una serie de 36 pacientes que precisaron transfusión sanguínea a una edad de 43,3±15,7 días19. De Boer et al reportan un 71%20. Son pocos los casos publicados de pacientes tratados con EPO por anemia tardía debida a enfermedad hemolítica por isoinmunización y en casi todos ellos los resultados demuestran la capacidad de la EPO para disminuir o evitar la necesidad de transfusión. Las mayores series publicadas son las de Donato et al21 y Ovali et al22,23, con otros casos aislados12,24–26. En estas referencias el tratamiento recae en pacientes con anemia tardía hiporregenerativa (o susceptibles de presentarla por sus antecedentes) secundaria a enfermedad hemolítica por isoinmunización Rh, aunque también se han tratado otros tipos de anemia hemolítica18,21,27. No existe una indicación específica para el empleo de EPO en estos casos y los autores que la han utilizado aducen para ello la voluntad de disminuir la necesidad de transfusiones de hematíes y, si es posible, el ingreso hospitalario.
No se conoce exactamente la etiología de la anemia tardía tras enfermedad hemolítica del RN por isoinmunización, aunque en su presentación intervienen diferentes variables: a) la destrucción de los hematíes circulantes y las de sus precursores intramedulares; b) unos valores de EPO bajos con relación al grado de anemia; c) inhibición medular secundaria a transfusiones o exanguinotransfusiones intrauterinas y/o posnatales; d) incapacidad de la médula ósea para mantener una eritropoyesis suficiente para compensar la hemólisis y la expansión de la volemia por el crecimiento, y e) la presencia de anticuerpos circulantes frente a los antígenos Rh (en caso de isoinmunización Rh) o de grupo ABO. Posiblemente sea el predominio de uno u otro de los factores o el mayor grado de avidez de los anticuerpos el que determine la gravedad del cuadro28.
Los primeros autores que emplearon EPO en el tratamiento de la anemia tardía en casos de enfermedad hemolítica lo hicieron basándose en unos valores de EPO bajos, mientras se mantenía una respuesta adecuada a ésta por parte de las células progenitoras de la serie roja in vitro12,29. Sin embargo, no es suficiente la corrección de los bajos valores de EPO para conseguir una eritropoyesis eficaz y posiblemente intervenga otro factor. Consistente con esto, no se halló correlación entre valores de EPO y recuento reticulocitario en 30 niños con isoinmunización Rh30. Normalmente, la médula ósea de estos pacientes muestra una hiperplasia eritroide que se correlaciona inversamente con el valor de Hb31. En contraste, algunos autores describen hipoplasia eritroide y un cociente mieloide:eritroide aumentado en los aspirados de pacientes con anemia hiporregenerativa, sugiriendo la acción de un factor que interfiere con la eritropoyesis16,32. Koenig et al14 mostraron que normoblastos de un paciente con anemia hiporregenerativa tenían una respuesta proliferativa normal a la EPO in vitro, sugiriendo que este factor no interfiere con la actividad de la EPO. Curiosamente se han encontrado anticuerpos anti-D junto a normoblastos en el aspirado medular de los pacientes con anemia hiporregenerativa, sin que hubiera reticulocitos33. Un niño con anemia hiporregenerativa que presentó un elevado valor de EPO y concomitantemente hiperplasia eritroide en el aspirado medular, tenía un recuento reticulocitario periférico de sólo el 0,8% y una Hb de 4,8g/dl15. La expresión del antígeno Rh se regula según el desarrollo: primero se detecta en los pronormoblastos y alcanza su expresión completa en los hematíes maduros34. El factor antieritropoyético postulado anteriormente puede ser idéntico a los anticuerpos anti-Rh que entran al espacio medular donde destruyen los reticulocitos y, en menor grado, otros precursores eritroides en un proceso de hemólisis intramedular34. La razón por la cual sólo ocurre en un subgrupo de RN afectados de isoinmunización Rh podría estar relacionada con la afinidad (avidez) de los Ac y diferentes patrones de expresión del Ag Rh. El tratamiento de la anemia hiporregenerativa con EPO puede no ser efectivo cuando los títulos de anti-D son altos y es prudente retrasar su indicación hasta que desciendan por debajo de un determinado valor, de momento desconocido28. Refrendando la importancia de la presencia de los anticuerpos anti-D en la anemia tardía hiporregenerativa, los niños sometidos a exanguinotransfusión después del nacimiento presentan un cuadro menos grave (el 64% no desarrolló anemia tardía en comparación con el 92% de los que no se exanguinaron)19.
De los niños tratados con EPO en nuestro estudio, los afectados de isoinmunización Rh presentaron los cuadros más graves y, sobre todo, los que habían recibido TIU. Las anemias tardías postisoinmunización que tenían los valores de reticulocitos más elevados mostraron mejor respuesta. El uso de TIU ha mejorado el pronóstico de la enfermedad hemolítica del RN por incompatibilidad Rh y ha modificado su evolución natural. Tras el nacimiento, la sangre del niño corresponde mayoritariamente a la del adulto recibida por las transfusiones y el Rh suele ser negativo. En muchas ocasiones nace bien o con cierto grado de anemia, presenta discreta ictericia y, entre la 2.a y la 6.a semana de vida, se desarrolla una anemia hiporregenerativa tardía que se caracteriza por reticulocitopenia y valores inadecuadamente bajos de EPO14,15,35–38. Se ha comprobado que los niños con isoinmunización Rh que recibieron TIU precisaron más TH que los que no las recibieron (el 77 frente al 26,5%) y sus recuentos reticulocitarios fueron inferiores al nacer (el 0,7 frente al 7,3%)13. Entre los factores predictivos de necesidad de transfusión posnatal precoz Messer et al apuntan una concentración de Hb baja al nacimiento, elevada carga de Ac, necesidad de múltiples TIU y ausencia de exanguinotransfusión al nacimiento36. Como en estos casos la reactivación espontánea de la eritropoyesis ocurre entre los 2 y los 4 meses de edad15 se suelen necesitar transfusiones durante ese período. El empleo de EPO en estos casos ha inducido un aumento reticulocitario que ha permitido elevar los valores de Hb12,39 y disminuir la necesidad de transfusiones. Ovali et al23, en el único estudio piloto con placebo, comprueban una disminución en el número de transfusiones entre los niños que recibieron EPO frente a los que no (1,8 frente a 4,2). Posteriormente, los mismos autores siguieron tratando sus pacientes con EPO anotando un descenso en el número de pacientes que precisaron transfusiones (55%) y un menor número de transfusiones por paciente22.
No sólo los niños con anemia tardía secundaria a enfermedad hemolítica por incompatibilidad Rh se han visto beneficiados por el tratamiento con EPO. Donato et al21 han publicado los resultados de 50 RN tratados cuya etiología incluía incompatibilidad Rh, ABO y KpA. Durante el tratamiento, 7 niños (14%) precisaron una TH. Estos resultados pueden considerarse satisfactorios teniendo en cuenta que la necesidad de transfusión en los casos de anemia tardía puede ser del 83%19. De nuestros 13 pacientes, que en el momento de iniciar el tratamiento estaban en valores analíticos de indicación de transfusión, sólo 2 hubieron de transfundirse (15%).
Otros autores han empleado la EPO en otros casos de enfermedad hemolítica del RN como esferocitosis18,40 e incompatibilidad frente a los antígenos del sistema Kell27,41 con resultados alentadores. De nuestros pacientes, en uno de ellos no se llegó a un diagnóstico específico de la causa de la hemólisis y el otro correspondió a un déficit de glucosa-6-P-deshidrogenasa.
El momento de inicio de la EPO varía desde las 2 semanas23,25 hasta los 70, 79 y 82 días12,24 a fin de frenar la necesidad de transfusión. Otros autores la han iniciado cuando se iniciaba el cuadro de anemia21. Para las dosis, la mayoría se basa en las aplicadas al prematuro (600–900U/kg/semana)12,21,23–25 que se comprobó inducían una estimulación significativa de la eritropoyesis42,43, y la duración oscila desde 10 días consecutivos12 hasta 3 semanas, con cifras intermedias de 3 semanas25 o 5 semanas22,23. En caso de esferocitosis, ajustando las dosis, se ha mantenido hasta los 14 meses18.
En resumen, no hay unanimidad de criterio para el empleo de EPO en el RN. Se alude a diferencias en los resultados, desconocimiento de las indicaciones específicas, momento de inicio, dosis y duración del tratamiento como factores que hacen difícil su recomendación de forma general. Pese a todo, y basándonos en los resultados obtenidos, creemos que el tratamiento con EPO para la anemia tardía de la enfermedad hemolítica del RN ha mostrado su utilidad para evitar la necesidad de transfusión y reingreso hospitalario con la angustia familiar correspondiente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.