Los tumores testiculares y paratesticulares constituyen el 1-2% de los tumores sólidos en la infancia. Se presenta una serie retrospectiva de 15 casos en menores de 18 años.
ResultadosLa edad media de los pacientes fue de 9,7 años, siendo prepuberales 6 (media 2,08 ± 1 año) y puberales 9 (media 15,1 ± 1,3 años). La forma de presentación clínica más frecuente fue una masa testicular indolora. Los niveles de α-fetoproteína estaban elevados en 5 pacientes (tumores de saco vitelino y carcinomas embrionarios).
El estudio anatomopatológico demostró 11 tumores primarios testiculares y 4 paratesticulares (rabdomiosarcomas), siendo el 60% tumores germinales y el resto de células no germinales. El 60% de ellos fueron tumores malignos (2 tumores de saco vitelino, 2 carcinomas embrionarios, un seminoma y 4 rabdomiosarcomas). Entre los tumores benignos, el más frecuente fue el teratoma quístico maduro. La cirugía fue el tratamiento inicial en todos los casos (orquidectomía radical en 13 tumores y enucleación en 2 teratomas, con linfadenectomía retroperitoneal en 4 casos). En 11 de los pacientes el tumor se encontraba en estadio I y en 4 casos (2 carcinomas embrionarios y 2 rabdomiosarcomas), en estadio IV con metástasis pulmonares. Recibieron tratamiento adyuvante con quimioterapia asociada o no a radioterapia 7 de los pacientes (4 rabdomiosarcomas, 2 carcinomas embrionarios y un seminoma).
ConclusionesLos tumores testiculares y paratesticulares en niños prepuberales son un grupo con unas características epidemiológicas, histológicas, evolutivas y terapéuticas, bien diferenciadas respecto de las encontradas en pacientes pospuberales o adultos.
Testicular and paratesticular tumors represent 1-2% of the solid tumors in children. We present a retrospective series of 15 cases in patients less than 18 years of age.
ResultsThe mean age of the patients was 9.7 yrs, 6 of them prepubertal (mean age: 2.08 ± 1 yrs) and 9 pubertal (mean age: 15.1 ± 1.3 yrs). The most common clinical form of presentation was a painless testicular mass. The α-fetoprotein levels were high in 5 patients (yolk-sac tumors and embryonal carcinomas).
The pathological study showed 11 primary testicular tumors and 4 paratesticular tumors (rhabdomyosarcomas), with 60% being germinal tumors and the rest non-germinal. Around 60% were malignant tumors (2 from the yolk-sac tumors, 2 embryonal carcinomas, one seminoma and 4 rhabdomyosarcomas). Among the benign tumors, the most common was the mature cystic teratoma. Surgery was the initial treatment in all of the cases (radical orchiectomy in 13 tumors and enucleation in 2 teratomas, with retroperitoneal lymphadenectomy in 4 cases). In 11 patients the tumor was in stage I, while 4 cases (2 embryonal carcinomas and 2 rhabdomyosarcomas) were in stage IV with pulmonary metastasis. Chemotherapy whether or not combined with radiotherapy was applied in 7 patients (4 rhabdomyosarcomas, 2 embryonal carcinomas and one seminoma).
ConclusionsTesticular and paratesticular tumors in prepubertal children show epidemiological, histological, therapeutical and evolutional characteristics well differentiated from postpubertal or adult subjects.
Los tumores testiculares y paratesticulares son poco frecuentes en la infancia1. En efecto, suponen el 1-2% de las neoplasias sólidas en la edad pediátrica y el 3% de todos los tumores testiculares2-4. La incidencia es de 0,5-2 por cada 100.000 menores de 18 años y ha permanecido relativamente estable en los últimos 30 años si se compara con el aumento de incidencia objetivado en adultos4-6.
En pacientes prepuberales, conforman un grupo de entidades con unas características epidemiológicas, histológicas, evolutivas y terapéuticas bien diferenciadas respecto de las encontradas en pacientes pospuberales y adultos1. La mayoría se consideraban malignos, pero estudios recientes ponen de manifiesto que los tumores testiculares en la infancia son en su mayoría benignos, lo que supone un cambio en su abordaje terapéutico inicial, cada vez más conservador7.
El objetivo de este estudio es describir las características epidemiológicas, las manifestaciones clínicas, los métodos diagnósticos, los tratamientos recibidos y las complicaciones de pacientes menores de 18 años diagnosticados de tumores testiculares y paratesticulares en nuestro centro desde 1999 hasta 2010, así como realizar una revisión de la literatura publicada, para contribuir a un mejor conocimiento de este grupo de patologías en la edad pediátrica.
Población y métodosSe ha realizado un estudio retrospectivo, observacional y descriptivo en el que se han revisado las historias clínicas de los pacientes menores de 18 años diagnosticados de tumores testiculares primarios y paratesticulares en nuestro centro desde el año 1999 hasta el 2010. Con intencionalidad, se han excluido de esta revisión todos los tumores secundarios, en su mayoría metástasis de linfomas y leucemias.
Se ha incluido a un total de 15 pacientes, de los cuales se han recogido datos epidemiológicos (edad en el momento del diagnóstico y desarrollo puberal según estadios de Tanner), forma de presentación clínica (motivo de consulta, síntomas asociados, localización del tumor), metodología diagnóstica (pruebas de imagen, marcadores tumorales), resultado del estudio anatomopatológico (basado en la clasificación histológica de tumores testiculares de la OMS 20048) y tratamiento que recibieron (cirugía y tratamientos adyuvantes).
ResultadosLos 15 pacientes estudiados eran menores de 18 años. La edad media en el momento del diagnóstico fue de 9,7 años (rango 0,58-16 años). El 40% (6 niños) eran prepuberales (estadio puberal de Tanner I), con una edad media de 2,08 ± 1 año (tabla 1); los otros 9 pacientes (60%) eran puberales, con una edad media de 15,1 ± 1,3 años (tabla 2).
Resumen de casos clínicos en pacientes prepuberales
| Prepuberales | ||||||
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | |
| edad | 1 año y 3 meses | 2 años | 2 años y 8 meses | 7 meses | 2 años | 3 años y 6 meses |
| AFP (ng/ml)* | 38,2 | Negativo | Negativo | 1.325 | 1.440 | No realizado |
| Histología | Teratoma | Teratoma | Neurofibroma benigno | Tumor de seno endodérmico | Tumor de seno endodérmico | Rabdomiosarcoma |
| Estadio tumoral | I | I | I | I | I | IV |
| Cirugía | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía + linfadenectomía |
| Quimioterapia | – | – | – | – | – | MMT-98 |
AFP: α-fetoproteína; MMT-98: protocolo de tratamiento para rabdomiosarcomas de la Sociedad Internacional de Oncología Pediátrica.
Resumen de casos clínicos en pacientes puberales
| Puberales | |||||||||
| Caso 7 | Caso 8 | Caso 9 | Caso 10 | Caso 11 | Caso 12 | Caso 13 | Caso 14 | Caso 15 | |
| Edad | 12 años y 11meses | 14 años y 4 meses | 14 años | 16 años | 13 años y 3 meses | 16 años y 16 meses | 14 años y 7 meses | 15 años y 10 meses | 16 años y 4 meses |
| AFP (ng/ml)* | Negativo | Negativo | No realizado | Negativo | 1.946 | 41,3 | Negativo | No realizado | Negativo |
| Histología | Teratoma | Teratoma | Seminoma | Tumor de células de Leydig | Carcinoma embrionario | Carcinoma embrionario | Rabdomiosarcoma | Rabdomiosarcoma | Rabdomiosarcoma |
| Estadio tumoral | I | I | I | I | IV | IV | I | IV | I |
| Cirugía | Enucleación | Enucleación | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía | Orquidectomía + linfadenectomía |
| Quimioterapia | – | – | BEP | – | BEP | BEP | MMT-SEOP 95/01 | MMT-98 | RMS-2005 |
| Radioterapia | – | – | – | – | – | – | SI | SI | – |
AFP: α-fetoproteína; BEP: bleomicina, etopósido, cisplatino; MMT-SEOP 95/01 y MMT-98: protocolos de tratamiento de la Sociedad Internacional de Oncología Pediátrica; RMS-2005: protocolo de tratamiento de la European Paediatric Soft Tissue Sarcoma Study Group.
La forma de presentación clínica más frecuente (87% de los casos) fue el aumento del tamaño testicular, a expensas de la presencia de una masa testicular palpable. No se asociaron dolor ni otros síntomas. El testículo más afectado fue el izquierdo, en 9 de los 15 pacientes.
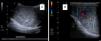
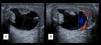
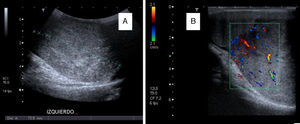
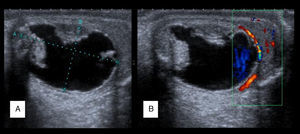
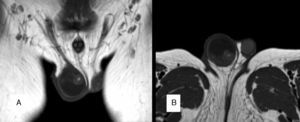
Los niveles de α-fetoproteína (AFP) estaban elevados en 5 de los pacientes (aquellos que presentaron tumor de saco vitelino o carcinoma embrionario). Se realizó una ecografía testicular en 11 de los 15 pacientes, confirmándose la presencia de una masa en 9 de los casos (figs. 1 y 2). Se hizo una estudio de extensión mediante pruebas de imagen (radiografía de tórax, escáner toracoabdominal, resonancia magnética (RM) y/o gammagrafía ósea) en 10 pacientes (fig. 3).
RM testicular correspondiente a teratoma quístico (A: corte coronal; B: corte transversal). Masa intratesticular en el teste derecho (18×20×19mm), sólido-quística, de predominio quístico. El escaso parénquima testicular respetado, laminar, se localiza en situación lateral, posterior y caudal. Teste izquierdo, normal.
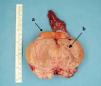
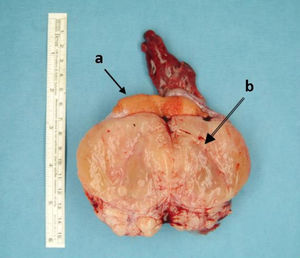
La cirugía fue el tratamiento inicial en todos los casos (fig. 4). Se realizó enucleación del tumor en aquellos en los que la biopsia intraoperatoria confirmó el diagnóstico de teratoma quístico maduro. En el resto de los casos se llevó a cabo una orquidectomía radical y, en 2 de ellos, en los que se habían detectado metástasis pulmonares en el estudio de extensión preoperatorio se practicó, además, una linfadenectomía retroperitoneal.
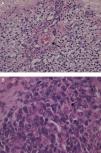
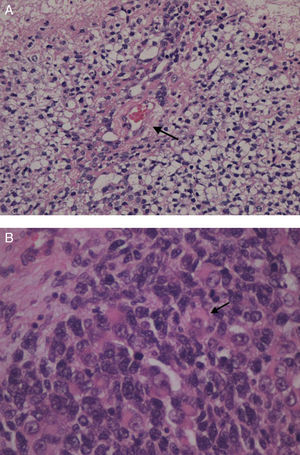
El estudio anatomopatológico de los 15 casos estudiados confirmó el diagnóstico de 11 tumores primarios testiculares y 4 tumores paratesticulares. El 60% de ellos fueron germinales y el resto, tumores de células no germinales. En el 60% de los casos el tumor fue maligno: 2 tumores de saco vitelino (fig. 5A), 2 carcinomas embrionarios y un seminoma. Los 4 tumores paratesticulares fueron rabdomiosarcomas embrionarios (fig. 5B). De los tumores benignos (40%), el más frecuente fue el teratoma quístico maduro (4 casos), diagnosticándose también un tumor de células de Leydig y un neurofibroma benigno.
A) Imagen microscópica de tumor testicular de saco vitelino: cuerpo de Schiller Duval (flecha). B) Imagen microscópica del estudio anatomopatológico de la tumoración de la figura 4: rabdomiosarcoma embrionario. Proliferación celular atípica de células pequeñas y redondas junto a células redondeadas con núcleos hipercromáticos irregulares y citoplasma amplio: rabdomioblastos (flecha).
En 11 de los casos (73%) el tumor se encontraba en estadio I y en 4 casos (27%), en estadio IV, según el sistema de estadificación de los tumores testiculares y paratesticulares malignos del Children's Cancer Group y el Pediatric Oncology Group (tabla 3)9. Los 4 casos de enfermedad diseminada fueron 2 carcinomas embrionarios y 2 de los rabdomiosarcomas, presentando todos ellos metástasis pulmonares.
Sistema de estadificación de los tumores testiculares y paratesticulares malignos (Children's Cancer Group and Pediatric Oncology Group)
| Estadio I | Enfermedad localizada en el testículo, sin evidencia radiológica ni anatomopatológica de extensión. Resección tumoral completa, con normalización de los marcadores tumorales. |
| Estadio II | Diseminación macro o microscópica en escroto o cordón espermático (a menos de 5cm del extremo proximal). Adenopatías retroperitoneales menores de 2cm. Persistencia de elevación de los marcadores tumorales. Orquidectomía transescrotal |
| Estadio III | Adenopatías retroperitoneales mayores de 2cm |
| Estadio IV | Metástasis a distancia |
Modificado de Ross10.
Además del tratamiento quirúrgico inicial, recibieron tratamiento adyuvante, con quimioterapia asociada o no a radioterapia, 7 de los 15 pacientes (los 4 rabdomiosarcomas, los 2 carcinomas embrionarios y el seminoma). Los rabdomiosarcomas se trataron con quimioterapia (según los protocolos RMS-2005 de la European Paediatric Soft Tissue Sarcoma Study Group (EpSSG) y MMT-95 o MMT-98 de la Sociedad Internacional de Oncología Pediátrica [SIOP], con vincristina, ifosfamida o ciclofosfamida y actinomicina D) y en los 2 que presentaban un estadio IV se asoció, además, radioterapia (dosis total 42Gy). Los 2 carcinomas embrionarios y el seminoma recibieron tratamiento quimioterápico con bleomicina, etopósido y cisplatino.
DiscusiónLa incidencia de tumores testiculares y paratesticulares es de 0,5-2 por 100.000 menores de 18 años1,4,5. La edad de presentación más frecuente en la infancia es entre los 2 y los 4 años (75% antes de los 3 años), con un descenso progresivo de la incidencia hasta los 15 años, para después volver a aumentar y presentar el pico de incidencia máximo en adultos jóvenes1,2,7,9,10,11. La serie que se presenta refleja también esta distribución bimodal, con una edad comprendida entre los 7 meses y los 3 años y medio en los pacientes prepuberales, y entre los 13 y los 16 años en los puberales.
Clásicamente, se ha considerado el tumor maligno de saco vitelino el tumor testicular más frecuente en la edad pediátrica (más del 60%), seguido de los teratomas (25%). Sin embargo, publicaciones recientes ponen de manifiesto que son más frecuentes los tumores benignos (cerca del 75%), situándose el teratoma en primer lugar (50%), seguido del tumor de saco vitelino (15%), quistes epidermoides (15%), tumores de células de la granulosa tipo juvenil (5%), tumores de células de Leydig (<5%), de células de Sertoli (<5%) y tumores indiferenciados mixtos (<5%). Otros tipos de tumores, que suponen el 10%, serían los gonadoblastomas, linfomas, displasias quísticas de la rete testis o seudotumores inflamatorios1,4,5.
En la serie de casos que se presenta predominan los tumores malignos (tumor de saco vitelino y carcinoma embrionario), si bien hay que tener en cuenta la posibilidad de que no se hayan registrado la totalidad de las masas testiculares benignas, como ocurre en otras series publicadas. Dentro de los tumores benignos, el más frecuente fue el teratoma, como se describe en la literatura.
El 65-75% de los tumores testiculares en menores de 15 años son de células germinales (teratomas, tumor de saco vitelino y quistes dermoides), similar a lo observado en nuestra serie. Los tumores de origen estromal (tumor de células de Leydig, de células de Sertoli, de células de la granulosa juvenil y los indiferenciados mixtos) son benignos en la edad pediátrica y suponen cerca del 15%. El gonadoblastoma contiene células germinales y estromales, y representa solo el 1%2,7,9.
Los tumores malignos se diseminan vía linfática y hematógena. La diseminación vía linfática a ganglios retroperitoneales solo ocurre en un 4-6%12. Las metástasis por diseminación hematógena tienen lugar en el 61% de los adultos y solo en el 9% de los niños, siendo lo más frecuente el pulmón (en el 20% de los tumores de saco vitelino)2, como ocurría en los 4 casos presentados que tenían metástasis a distancia.
La mortalidad en la infancia es baja, teniendo el cáncer testicular prepuberal una supervivencia del 99% a los 5 años1.
Manifestaciones clínicasLos tumores testiculares se suelen presentar, en más del 90% de los casos, como masas escrotales indoloras, como se observa en nuestra serie. Menos del 10% refiere dolor testicular y cuando este aparece, suele estar en relación con hemorragia o necrosis testicular. Menos del 10% refiere el antecedente de un traumatismo, hidrocele o hernias.
La palpación pondrá de manifiesto la presencia de una masa sólida de consistencia pétrea, sin signos de inflamación. En el 15-50% de los tumores testiculares existe hidrocele1,12-14. La exploración es esencial en el diagnóstico diferencial de otras patologías de origen traumático o inflamatorio, como las torsiones testiculares, orquiepididimitis, hidroceles o hernias inguinales15,16. Algunos tumores testiculares se acompañan de pubertad precoz o ginecomastia4.
DiagnósticoLa evaluación de una masa testicular en un niño será similar a la de los adultos, mediante ecografía testicular y marcadores tumorales: AFP y subunidad beta de la hormona gonadotropina coriónica humana (β-hCG)14,17.
La ecografía tiene casi un 100% de sensibilidad para detectar neoplasias testiculares. El eco-Doppler puede ser de utilidad para el diagnóstico, valorando un posible aumento del flujo vascular1. Los tumores benignos aparecerán como masas bien definidas, de bordes delimitados y escasa vascularización. Los quistes epidermoides aparecen como lesiones intratesticulares bien delimitadas, con un área central hipoecogénica rodeada de un halo hiperecogénico. Los tumores del saco vitelino tienen una apariencia más sólida, hipoecoica y homogénea1,18.
Los marcadores tumorales son útiles para el diagnóstico y el tratamiento de la evolución de la enfermedad metastásica. La AFP es una proteína precursora de la albúmina sintetizada por el saco vitelino y el hígado fetal, con una vida media de 5-7 días. Sus niveles pueden estar normalmente elevados en recién nacidos durante los 6-8 primeros meses de vida (hasta 50.000 ng/ml en recién nacidos, 10.000 ng/ml a las 2 semanas, 300 ng/ml a los 2 meses, 12 ng/ml a los 6 meses) y en niños con hepatopatías19. Es el marcador más importante en pacientes prepuberales, ya que sus niveles se encuentran elevados en el 80-90% de los tumores de saco vitelino2. Los teratomas pueden producir un ascenso de los niveles de AFP, pero en un rango mucho menos elevado. Sus niveles se negativizarían (<20 ng/ml) tras un mes de la extirpación completa del tumor, por lo que niveles persistentemente elevados nos indicarían la presencia de metástasis o recurrencias1,2,4.
En la serie de casos presentada, apareció elevación de los niveles séricos de AFP en los tumores de saco vitelino y en los carcinomas embrionarios, tanto puberales como prepuberales. La β-hCG, con una vida media de 24-36h, es secretada por el sincitiotrofoblasto de la placenta y por algunos tumores, como el coriocarcinoma y el tumor mixto (gonadoblastoma)1,2.
Los niveles de testosterona podrían elevarse en tumores de células de Leydig4. La lactato deshidrogenasa (LDH) es poco específica, pero aparecerá elevada sobre todo en los pacientes con enfermedad metastásica, como marcador de destrucción tisular14.
Para la estadificación del tumor (presencia de metástasis y adenopatías retroperitoneales y mediastínicas) se realizará una radiografía de tórax y una RM o escáner toracoabdominopélvico12.
No está indicada la biopsia por punción de las masas testiculares, ya que esta técnica podría favorecer la diseminación tumoral14. El diagnóstico de certeza vendrá dado por el resultado de la anatomía patológica tras la extirpación quirúrgica (tumorectomía u orquidectomía) por vía inguinal. De existir dudas, se puede realizar una cirugía exploradora y obtener biopsia testicular para efectuar un examen histológico de cortes congelados14,20.
Tipos histológicos y tratamientoEl tratamiento de los tumores testiculares y paratesticulares dependerá del tipo histológico, así como de la estadificación del tumor. Los más frecuentes son los siguientes:
TeratomasSuelen ser benignos en pacientes prepuberales, pero pueden ser malignos cuando aparecen en adultos. Son más frecuentes entre los 0 y los 18 meses de edad, situándose la media en 13 meses. Histológicamente, presentan una combinación de componentes de las 3 capas embriológicas primitivas (ectodermo, endodermo y mesodermo), de las que se derivan epitelios, grasa, cartílago, hueso, músculo y elementos neurales. Ecográficamente, aparecen como masas muy heterogéneas, que pueden tener calcificaciones en su interior. Ya que tienen un curso benigno, su tratamiento suele ser conservador. Podría realizarse tumorectomía en aquellos tumores testiculares en los que en la ecografía el tejido testicular normal parece viable, con niveles de AFP normales, o en menores de 12 meses con niveles de AFP alta, pero menor de 100 ng/ml. Se debe realizar un abordaje inguinal para aislar el cordón espermático y, tras la enucleación del tumor, recolocar el testículo. Cuando el tumor no es palpable, la ecografía intraoperatoria ayudaría a localizar la lesión intratesticular. En series de casos que han recibido este tratamiento, se ha comprobado que no se producen recurrencias del tumor ni atrofia del testículo en los siguientes 4-8 años1,4,21-23.
Tumor del saco vitelino y carcinoma embrionarioEs el tumor testicular maligno más frecuente en la infancia. Son tumores sólidos, que aparecen sobre todo en menores de 2 años. También denominado tumor del seno endodérmico, carcinoma embrionario juvenil, adenocarcinoma de células claras o mesoblastoma extraembrionario1.
El tratamiento se basa en la orquidectomía radical mediante abordaje inguinal. En adultos se hace inicialmente linfadenectomía retroperitoneal radical, mientras que en los niños dependerá del estadio de la enfermedad mostrado por las pruebas de imagen y los marcadores tumorales. Esto es debido a que la mayoría de los casos prepuberales (85%) presentan un estadio I, por solo el 35% de los pospuberales. El 90% de los casos tienen elevación de la AFP, lo que es de utilidad para el seguimiento tras la cirugía y la detección de eventuales recaídas. Suelen metastatizar por vía hematógena, siendo las metástasis pulmonares las más frecuentes (20% de los prepuberales, frente al 4-6% de los adultos) y afectación de ganglios retroperitoneales (hasta en el 50%). Por tanto, la linfadenectomía radical en la infancia se reserva para casos en los que persisten adenopatías retroperitoneales y elevación de la AFP tras la orquidectomía radical y quimioterapia.
En estadio I, con normalización de los niveles de AFP tras la cirugía, no está indicada la quimioterapia adyuvante. El riesgo de recurrencia es del 20%, por lo que será necesario monitorizar los niveles de AFP cada 2-3 meses, así como realizar radiografía de tórax cada 2-3 meses y RM o TC cada 3-4 meses, durante los 2 primeros años (TC cada 6 meses en el 2° año). Pacientes con estadio II o metástasis (estadio III y IV) deberán ser tratados con quimioterapia tras la cirugía, efectuándose linfadenectomía retroperitoneal radical si se observa persistencia del tumor tras 2 ciclos.
Tumores estromalesSon raros en edad prepuberal, por lo que no existen grandes series que guíen la actitud terapéutica en niños.
El que aparece con más frecuencia es el tumor de células de Sertoli, sobre todo entre los 4 meses y los 10 años, con pico de incidencia a los 6 meses. El 10% son hormonalmente activos, provocando pubertad precoz o signos de feminización, como ginecomastia. Un tercio se asocian a síndromes u otras alteraciones endocrinológicas, como el síndrome de Peutz-Jeghers, el complejo de Carney, la enfermedad de Cushing o los adenomas hipofisarios. Suelen ser tumores bien delimitados, con áreas de hemorragia en su interior. La extirpación del tumor en niños suele ser curativa, debiendo estudiar la posible presencia de metástasis en casos de tumores grandes, con áreas de necrosis, invasión vascular, atipias celulares o aumento del índice de mitosis. Los pocos casos malignos suelen aparecer en niños mayores, por lo que se recomienda en mayores de 5 años la realización de orquidectomía radical y seguimiento posterior. Si aparecen metástasis se realizará, además, linfadenectomía retroperitoneal radical y tratamiento adyuvante con quimioterapia y radioterapia1,4.
Los tumores de células de Leydig aparecen entre los 5-10 años como una masa testicular indolora o con signos de pubertad precoz. Son benignos, aparecen como nódulos bien delimitados y no metastatizan, por lo que la extirpación del tumor suele ser curativa.
El tumor de células de la granulosa tipo juvenil suele aparecer en el primer año de vida, normalmente en los primeros 6 meses, siendo el tumor testicular más frecuente en neonatos. Los niveles de AFP son negativos y los de inhibina A, positivos.
Tumores paratesticularesEl rabdomiosarcoma es el tumor paratesticular maligno más frecuente (40%), suponiendo el 5% de los tumores testiculares y paratesticulares malignos. Es el sarcoma de cordón espermático más frecuente. El rabdomiosarcoma paratesticular supone el 7% de todos los rabdomiosarcomas. Su edad de distribución es bimodal, con un pico a los 3-4 meses y otro a los 16 años.
Se presentan como grandes masas indoloras (hasta 20cm de diámetro) y metastásicas hasta en el 40% en el momento de su presentación. En el estudio ecográfico se observa una masa heterogénea sin otros hallazgos diferenciadores. Infiltra localmente los tejidos adyacentes y metastatiza por vía hematógena y linfática. Hasta un 70% de los pacientes presentan metástasis linfáticas regionales y un 25% metástasis pulmonares y óseas. Para la estadificación del tumor será necesaria la realización de una TC toracoabdominopélvica, función hepática, búsqueda de metástasis óseas y aspirado de médula ósea.
Aún en la actualidad existen controversias, en función de la edad y el tamaño del tumor primario, sobre el tratamiento de niños con radbdomiosarcomas paratesticulares no metastáticos (RMS)24. En efecto, los resultados de la SIOP indican que la linfadenectomía paraaórtica no es necesaria en el tratamiento de tumores bien localizados, no practicándose de rutina la orquidectomía radical con linfadenectomía retroperitoneal radical, como anteriormente se había hecho. Quienes así opinan prefieren exclusivamente quimioterapia. En pacientes de 10 años o mayores independientemente del estadio y en menores de 10 años con diseminación retroperitoneal se realizará una orquidectomía por vía inguinal con linfadenectomía retroperitoneal radical. Si se objetiva la afectación linfática tras la linfadenectomía, recibirán además radioterapia y quimioterapia con vincristina, actinomicina D y ciclofosfamida.
La supervivencia es mayor en prepuberales, siendo del 90% a los 3 años en niños con 3-4 meses, comparado con el 63% en adolescentes, considerándose indicadores de peor pronóstico la edad mayor de 7 años, el tipo histológico alveolar, la diseminación retroperitoneal no resecable o las metástasis a distancia1,4,25-27.
En la actualidad, se sugieren las recomendaciones del Protocolo EpSSG RMS 200528.
En conclusión, a pesar de que los tumores testiculares y paratesticulares representan entidades poco frecuentes en la infancia y la adolescencia, su conocimiento es de gran relevancia para un diagnóstico y un tratamiento adecuados, dadas sus características histológicas, evolutivas y terapéuticas, bien diferenciadas respecto de las encontradas en pacientes pospuberales o adultos. Su escasa incidencia hace que las guías terapéuticas universales sean difíciles de conseguir y que, en muchos casos, aun se analicen ciertos aspectos terapéuticos desde la experiencia de diferentes grupos con tratamientos individualizados no comparables.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.