El objetivo del presente trabajo es demostrar si la aplicación del índice biespectral (BIS®) en la monitorización de la anestesia general en respiración espontánea en endoscopias digestivas altas (EDA) diagnósticas en el paciente pediátrico es útil para: a) disminuir la dosis de fármaco necesaria; b) disminuir el tiempo del despertar, y c) mejorar la seguridad del paciente.
Pacientes y métodoestudio prospectivo cuasi experimental de casos y controles en el ámbito de una unidad de cuidados intensivos pediátricos y neonatales de segundo nivel.
Pacientesniños entre 12 meses y 13 años. Caso: paciente ASA I que precisa EDA diagnóstica; sujetos elegibles 36, participantes 30. Población control: serie histórica de pacientes que precisaron EDA (años 2008-2010): 50 pacientes.
Intervencionesrealización de EDA, aplicando protocolo de anestesia, monitorización de constantes vitales, nivel de sedación (escala de Ramsay) y nivel BIS.
Variables de interésdosis total de propofol (mg/kg), tiempo de inducción, tiempo de EDA y tiempo de despertar (min); índice BIS al inicio de la EDA (BISi) y durante la EDA; efectos adversos.
ResultadosSin diferencias significativas entre casos (B) y controles (C) respecto a sexo, edad y peso. Sin diferencias significativas en: dosis total de propofol (B 4,9 ± 1,4mg/kg; C 5,2 ± 1,6mg/kg, p = 0,492), Tiempo de despertar (B 12,2 ± 4,6min; C 12,8 ± 4,4min, p = 0,402), tiempo de procedimiento (B 9,5 ± 4,8min; C 11,3 ± 6,5min, p = 0,335) y tiempo de inducción (B 11,1 ± 2,6min; C 10,1 ± 4,2min, p = 0,059). BISi 55,4 ± 6,9. Sin diferencias significativas en efectos adversos (2 casos de desaturación leve en el grupo control).
ConclusionesLa monitorización anestésica con índice biespectral en endoscopias digestivas altas en respiración espontánea en la población pediátrica es factible, pero no parece disminuir ni la dosis de fármaco necesaria ni el tiempo de despertar. Tampoco disminuye la incidencia de efectos adversos de forma significativa.
The objective of this investigation is to determine whether bispectral index (BIS®) monitoring during intravenous anaesthesia with spontaneous breathing for upper gastrointestinal endoscopy (UGE) in a pediatric population is useful for: a) decreasing the amount of drug, b) decreasing the time for awakening, and c) improving patient safety.
Patients and methodA quasi-experimental case-control prospective study was conducted in the setting of a second level hospital pediatric intensive care unit.
PatientsChildren aged 1-13 years. Case: ASA I patient who needed a diagnostic UGE; eligible, 36, participants, 30. Control: historical cohort of patients who needed UGE (years 2008-2010): 50 patients.
InterventionUGE performed with anaesthetic protocol, vital signs monitoring, sedation level (Ramsay scale) and BIS monitoring.
Variables of interestpropofol total dose (mg/kg), induction time, time in performing the UGE, awakening time (min); initial BIS (iBIS), and BIS during the UGE; adverse effects.
ResultsThere were no significant differences in sex, age or weight between case (B) and control (C) population. No significant differences in total propofol doses: (B 4.9 ± 1.4mg/kg; C 5.2 ± 1.6mg/kg, P=.492), awakening time (B 12.2 ± 4.6min; C 12.8 ± 4.4min, P=.402), time for execution of UGE (B 9.5 ± 4.8min; C 11.3 ± 6.5min, P=.335) and induction time (B 11.1 ± 2.6min; C 10.1 ± 4.2min, P=.059), iBIS 55.4 ± 6.9. There were no significant differences in adverse effects: 2 patients suffered from mild desaturation in the control group.
ConclusionsBIS monitoring for diagnostic UGE in spontaneous breathing in a pediatric population is feasible, but does not appear to decrease awakening time or the amount of propofol needed. Furthermore, there was no statistically significant decrease in the number of adverse effects.
El paciente pediátrico precisa sedación profunda para muchos procedimientos invasivos que se realizan en respiración espontánea1. Clínicamente existen varias escalas para cuantificar el grado de sedación (Ramsay modificada, escala de sedación de la Universidad de Michigan, etc.)2. Hoy se sabe que existe diferencia interindividual de las necesidades anestésicas, frecuentemente por un mecanismo de polimorfismo genético y que la adecuación de la anestesia en función del peso del paciente, aun considerando la edad, no es un mecanismo suficientemente exacto para dosificar los fármacos anestésicos3,4.
El índice biespectral (BIS®) se obtiene de procesar las señales electroencefalográficas, mediante un sensor no invasivo que se aplica en la frente del paciente5,6. Este sensor convierte el EEG (electroencefalograma) del paciente a un índice que tiene un valor de 0 a 100 (0 indica coma profundo y 100 actividad de vigilia normal). Se usa para monitorizar la profundidad anestésica y dosificar los fármacos, tratando de mantener un nivel de sedación adecuada, evitando «superficialización» de la profundidad anestésica. La opción de disponer un método no invasivo que monitorice la actividad electroencefalográfica y que lo resuma en un índice cuantitativo validado es muy atractiva7–10. La revisión Cochrane del 200711 indica que el BIS disminuye los episodios de despertar intraoperatorio y el tiempo de recuperación anestésica; Paspatis et al.12 encuentran que en adultos que han recibido colangiopancreatografía retrógrada endoscópica (CPRE), la aplicación del BIS disminuye la dosis de propofol necesaria.
Por ello se plantea un estudio para comprobar si la aplicación del índice biespectral (BIS®) en la monitorización de la anestesia general en respiración espontánea en endoscopias digestivas altas (EDA) diagnósticas en el paciente pediátrico es útil para: a) disminuir la dosis de fármaco necesaria; b) disminuir el tiempo del despertar, y c) mejorar la seguridad del paciente.
Pacientes y métodoPoblación de referencia: población pediátrica (un año de vida hasta los 13 años). Población diana: criterios de selección: a) inclusión: edad mayor de 12 meses y menor de 14 años y realización de EDA; b) criterios de exclusión: pacientes con déficit neurológico conocido, pacientes con insuficiencia renal y/o hepática, pacientes en tratamiento anticonvulsivante, pacientes con clasificación de riesgo anestésico ASA III o IV, endoscopia digestiva alta realizada para extracción de cuerpo extraño y negativa de los padres a la firma del consentimiento informado.
Estudio prospectivo cuasi experimental de casos y controles. Realizado en la UCI pediátrica del complejo hospitalario de Jaén. El estudio fue aprobado por el comité de ética y de ensayos clínicos e investigación del hospital, según los principios de la declaración de Helsinki. Se obtuvo la autorización de los padres de los individuos. Caso: paciente ASA I que precisa EDA diagnóstica; periodo de septiembre de 2011 y junio de 2012. Población control: serie histórica de pacientes que precisaron EDA (años 2008-2010).
MétodoA todos los pacientes que cumplían los criterios de inclusión se procedió con el siguiente esquema:
- 1.
Petición de estudio analítico previo para descartar alteraciones en la función hepática, renal o coagulopatía. Si era normal se procedía al siguiente paso.
- 2.
Información a los padres sobre el procedimiento invasivo que se va a realizar y el estudio científico que se va a desarrollar. Petición del consentimiento informado para el estudio. Si la edad del niño y/o su madurez se consideraban adecuadas se les informaba del procedimiento, aunque su opinión no se consideró pertinente por parte de los padres para realizar o no la endoscopia.
- 3.
Ingreso programado en ayunas en la UCI Pediátrica.
- 4.
Monitorización no invasiva (Monitor Siemens SC 7000, Draeger Medical Systems, EE.UU.) de frecuencia cardiaca, frecuencia respiratoria, presión arterial no invasiva y oximetría de pulso transcutánea.
- 5.
Aplicación del sistema de monitorización BIS de forma continua (Monitor BIS Vista, unidad de procesamiento BIS × 4, sensores BIS Pediatric, Aspect Medical Systems, EE.UU.).
- 6.
Medida inicial y luego cada 3-5 min del nivel de sedación de la escala de Ramsay.
- 7.
Aplicación de oxigenoterapia en gafas nasales a 1 o 2 l/min.
- 8.
Administración de los fármacos anestésicos siguiendo este protocolo de anestesia general estándar con: fentanilo, bolo de 1 μg/kg y propofol bolo 1-2mg/kg en 3-5 min y perfusión continua de propofol a 3-4mg/kg/h, adecuación de sucesivos bolos (0,5-1mg/kg de propofol) o incremento del ritmo de perfusión (si tras 2 bolos extra de propofol no se obtiene un adecuado nivel en la escala de Ramsay de 5-6), hasta un máximo de 6-7mg/kg/h. Objetivo con la inducción anestésica: obtención de un nivel BIS estable (± 5 U respecto al BIS inicial) y nivel de sedación Ramsay 5-6 y su mantenimiento. Los fármacos se administran de acuerdo con la ficha técnica. Las dosis se calculan con los datos del sistema de administración Perfusor compact (Braun, Alemania).
- 9.
Realización de la técnica invasiva.
- 10.
Vigilancia de efectos adversos: hipotensión arterial (definida como cifra de presión arterial menor del percentil 10 para su edad o peso), desaturación menor de 85% o reacción alérgica a alguno de los fármacos anestésicos.
- 1.
Dependientes: dosis total de propofol administrada, indexada por peso del paciente (mg/kg); tiempo de despertar (periodo desde la finalización del procedimiento invasivo hasta obtener Ramsay 2), min; índice BIS (0-100). Tiempo de inducción anestésica (min).
- 2.
Independientes: edad, sexo y peso del paciente; tiempo (duración) de procedimiento invasivo; nivel de Ramsay (1-6).
- 1.
Para comprobar la homogeneidad de los casos y los controles se han utilizado los siguientes tests: edad y peso con el test no paramétrico de la U de Mann-Whitney; variable sexo: test exacto de Fisher.
- 2.
Variables de dosis total, tiempo de despertar y tiempo de inducción: previamente a los análisis se han realizado los tests de normalidad (se ha usado el test de Shapiro-Wilk, ya que uno de los grupos tiene menos de 50 observaciones; el resultado de dicho test indica que las variables no se distribuyen de forma normal). De este modo, para comprobar si existen diferencias, se utilizó el test no paramétrico de la U de Mann-Whitney. Todos los tests se estudian a un nivel de significación α = 0,05.
- 3.
Para estudiar las posibles diferencias entre los efectos adversos sufridos en el grupo de los casos y los controles se ha calculado el test exacto de Fisher.
- 4.
Tamaño de muestra: para conseguir una potencia del 80,00% para detectar diferencias, mediante una prueba de la t de Student unilateral (de superioridad) para 2 muestras independientes, sería necesario incluir 68 unidades experimentales en el grupo de referencia y 68 unidades en el grupo experimental, totalizando 136 unidades experimentales en el estudio.
Grupo casos (grupo BIS): 36 pacientes elegibles, 30 participantes. Grupo control 50 pacientes. Los valores de las variables se expresan en la tabla 1. No se encontraron diferencias significativas en edad (p = 0,118), peso (p = 0,054) ni sexo (p = 0,231).
Variables de interés en ambos grupos
| Media | p | ||
| BIS | Control | ||
| Edad (años) | 7,40±3,77 | 6,02±4,37 | 0,118 |
| Peso (kg) | 29,03±13,90 | 24,48±15,94 | 0,054 |
| Dosis total (mg/kg) | 4,94±1,39 | 5,19±1,60 | 0,492 |
| Tiempo de inducción (min) | 11,100±2,57 | 10,06±4,26 | 0,059 |
| Tiempo de duración de la EDA (min) | 9,56±4,80 | 11,36±6,58 | 0,335 |
| Tiempo de despertar (min) | 12,267±4,64 | 12,78±4,45 | 0,402 |
Dosis total, tiempo de despertar y el tiempo de inducción: no encontramos diferencias significativas (p = 0,492, 0,402 y 0,059, respectivamente) (tabla 1).
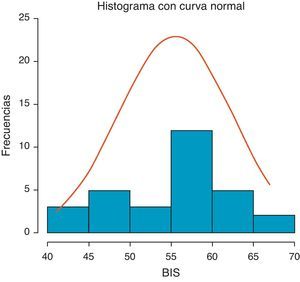
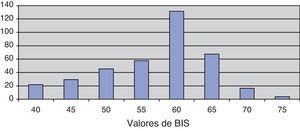
Los valores del BIS de inicio (BISi) expresados en media±DE fueron 55,4±6,9, con rango intercuartílico de 49-60,25. En la figura 1 está su distribución. Los valores de BIS durante el procedimiento se pueden apreciar en la figura 2.
En el grupo BIS no hubo ningún efecto adverso; en el grupo control hubo 2 episodios de desaturación leve (saturación del 80-84%): en un paciente por apnea que se resolvió permeabilizando la vía aérea y disminuyendo el ritmo de perfusión del propofol y en otro por un episodio de laringoespasmo que se solucionó profundizando el grado de anestesia. El análisis estadístico de estos efectos adversos muestra un valor p = 0,525, por lo que no existen diferencias estadísticamente significativas entre la proporción de pacientes que presentan efectos adversos en el grupo de los casos, 0% (0 efectos adversos), y el de los controles, 4% (2 efectos adversos).
DiscusiónLa monitorización BIS es útil para mejorar la seguridad del paciente11. Aunque la aplicación del sensor conlleva un gasto económico, al reducir el coste de fármaco12–14 no desaconseja su aplicación en la práctica anestésica. El propofol es un fármaco ampliamente usado en pediatría14–17 y una administración lenta en la inducción permite disminuir el riesgo de apnea18. Por ello se eligió como fármaco a administrar en el protocolo. Se decidió tomar como objetivo de la inducción el conseguir un valor en la escala de Ramsay de 5-6 y un valor BIS estable durante al menos 1 min y posteriormente mantener el valor BIS cercano al BIS de inicio (BISi), por la buena correlación BIS-valor escala de sedación7–10. No se eligió como objetivo inicial de la inducción un valor de BIS pues, como comprobaron Powers et al.19, existe un rango del mismo relativamente amplio como para aconsejar a priori un valor determinado como objetivo. Se descartó la población menor de 1 año, pues la conversión del EEG al índice BIS usa algoritmos extrapolados de población adulta y no está suficientemente validado en los lactantes.
Aunque el estudio es cuasi experimental, el grupo control recibió el mismo protocolo anestésico y son poblaciones comparables. Se descartaron los pacientes que previamente hubieran recibido algún sedante adicional (midazolam). Los resultados muestran que hay una disminución leve en la cantidad de propofol en el grupo BIS, no estadísticamente significativa. Así mismo, el tiempo de despertar es ligeramente menor en el grupo BIS, sin diferencia estadísticamente significativa. Nuestra serie de pacientes y de controles no fue suficientemente extensa para conseguir una potencia adecuada. Es de destacar que no hubo incidencias en el grupo BIS, como sí hubo en el grupo control, probablemente relacionadas con una profundidad anestésica excesiva o inadecuada, aunque no fueron significativas. Merece destacar que el BIS durante el procedimiento tuvo algunos registros entre 40-45 sin apreciarse desaturación de los pacientes.
Aunque no se incluyó en el estudio, la determinación del CO2 espirado podría ser de utilidad para detectar episodios de hipoventilación ocultos.
En conclusión, el estudio realizado muestra que la monitorización anestésica con el BIS es factible en las endoscopias digestivas altas. No se encontró que disminuyera de forma significativa ni la dosis de propofol ni el tiempo de despertar anestésico. Tampoco disminuyó de forma significativa la incidencia de efectos adversos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Unidad de Apoyo a la Investigación de nuestro centro (Dña. María del Carmen Rosa). Al personal de enfermería de la UCI Pediátrica del Complejo Hospitalario de Jaén.