La hipertensión intracraneal (HITC) es la principal causa de mortalidad y secuelas de los pacientes con traumatismo craneoencefálico grave. La craniectomía descompresiva (CD) es una técnica quirúrgica que permite disminuir la presión intracraneal y mejorar la presión de perfusión cerebral (PPC). El objetivo del trabajo es presentar la experiencia con la CD para el tratamiento de la hipertensión intracraneal.
Pacientes y métodosRevisión retrospectiva de los pacientes ingresados entre los años 2005–2008 con lesión cerebral e hipertensión intracraneal incontrolable médicamente a los que se les realizó una CD como terapia.
ResultadosSe incluyen 14 pacientes con traumatismo craneoencefálico grave con una mediana de edad de 14,2 años (4–20 años). Las lesiones detectadas más frecuentemente en la TC craneal de los niños con traumatismo fueron las lesiones encefálicas difusas II y III. En todos se practicó una CD por presentar cifras de presión intracraneal elevadas refractarias a la terapéutica instaurada. La evolución fue favorable en todos los pacientes salvo en 2. El 78,8% presenta una buena evolución neurológica (Glasgow Outcome Score 4 y 5) a los 6 meses de la intervención.
ConclusiónLa CD es una alternativa en el manejo de la hipertensión intracraneal refractaria al tratamiento médico en niños y adolescentes que han sufrido un traumatismo craneoencefálico grave y puede ser usada simultáneamente o como alternativa al coma barbitúrico sobre todo en aquellos pacientes con inestabilidad hemodinámica.
Intracranial hypertension (ICH) is the main cause of morbidity and mortality in patients with severe traumatic head injuries. Decompressive craniectomy (DC) is a surgical technique that allows to reduce intracranial pressure (ICP) and to improve cerebral blood flow.
ObjectiveTo present our experience on DC for the treatment of ICH.
Patients and methodsRetrospective review of patients admitted from January 2005 to December 2008 who had a traumatic brain injury (TBI) and uncontrollable intracranial hypertension despite optimal medical treatment and who needed DC.
ResultsFourteen patients with severe TBI were included in this series. Mean age was 14.2 years (4–20 years). The more frequent damages detected in cranial computerized tomography were diffuse brain lesions types II and III. Indication for DC was made if ICP levels were above 25mmHg for more than 30min despite optimal medical treatment. Clinical outcome was favourable in all patients apart from two. Neurological outcome was correct in 78.8% of patients (Glasgow Outcome Score 4 and 5) six months after PICU discharge.
ConclusionDC is an alternative for the management of refractory intracranial hypertension in children and adolescents with severe TBI. It could be used simultaneously with the barbiturate coma or as an alternative, particularly in haemodynamically unstable patients.
La hipertensión intracraneal (HTIC) es la principal causa de mortalidad y secuelas en pacientes con traumatismo craneoencefálico grave (TCEG). Las guías actuales para el manejo del TCEG recomiendan la monitorización de la presión intracraneal (PIC) en pacientes con un nivel de conciencia medido por la Glasgow Coma Scale (GCS) igual o menor a 8 puntos, con el objetivo de mantenerla por debajo de los 20mmHg y obtener una presión de perfusión cerebral (PPC) entre 50–60mmHg. El tratamiento de la HTIC está muy estandarizado y es escalonado, mientras que otros tratamientos como la craniectomía descompresiva (CD) se utilizan cuando las medidas previas para el control de la PIC y PPC fallan. El uso de la CD se ha reportado desde el siglo XIX para el tratamiento de la HTIC refractaria al resto de tratamientos, tanto en pacientes con TCEG, como en pacientes con enfermedades vasculares o infecciosas del sistema nervioso central1–4.No obstante, la CD continúa siendo controvertida, por considerarse en ocasiones demasiado agresiva. Las guías actuales del manejo del TCEG recomiendan valorar su utilización en pacientes con HTIC refractaria a los tratamientos del primer escalón terapéutico y en aquellos pacientes que tienen riesgo de herniación secundaria a la lesión intracraneal5,6. Se debe tener en cuenta que la efectividad de la CD aumenta cuando se realiza en las primeras 48h tras el TCEG7–9. El objetivo del presente trabajo es mostrar nuestra experiencia en el uso de la CD para el control de la HTIC.
Pacientes y métodosCentroEl estudio se realiza en pacientes ingresados en la Unidad de Cuidados Intensivos Pediátricos (UCIP) de un hospital pediátrico de tercer nivel tercer nivel dotada de 14 camas.
Población de estudioSe incluyen los pacientes ingresados en la UCIP entre los años 2005–2008 que presentaron TCEG con HTIC refractaria al tratamiento médico optimizado, a los que se realiza una CD para lograr el control de la PIC. En todos ellos se monitorizó la presión endocraneal mediante sensor parenquimatoso Camino® (Integra Neurosciences, Plainsboro, NJ, EE.UU.). Se siguió un tratamiento escalonado en 2 niveles, en el primer nivel se plantea como objetivo controlar la PIC por debajo de 20mmHg, para ello si no existe inicialmente lesión tributaria de evacuación quirúrgica, se realiza sedoanalgesia con cloruro mórfico y midazolam, si no se controla la PIC se añade relajación con agentes curarizantes, ante la imposibilidad de control se inicia tratamiento con agentes osmóticos, manitol o suero salino hipertónico al 4%, en función de la respuesta y de la osmolaridad utilizando el manitol hasta osmolaridad sérica por debajo de 320 y menor a 360 con el suero salino hipertónico, como opción posterior se añade hiperventilación ligera para mantener una PaCO2 entre 30 y 35mmHg, y si no se consigue el control de la PIC se inician las medidas de segunda línea incluidas en nuestro protocolo: hiperventilación por debajo de 30mmHg con monitorización de la saturación yugular de O2 si no existe sospecha de isquemia; coma barbitúrico y CD. Para la indicación de la descompresión quirúrgica se ha situado el nivel de la PIC de manera mantenida por encima de 25mmHg sin respuesta a las medidas de primer nivel durante un periodo entre 30–60min, acortando este periodo en función de la gravedad de la hipertensión. La indicación de CD así como el momento quirúrgico y la técnica usada fue en cada caso consensuado por el equipo médico de la UCIP y de neurocirugía.
Recogida de datosSe revisa de forma retrospectiva/prospectiva la historia clínica de los pacientes incluidos. En cada caso se recogen además de los datos de filiación, los datos referentes a la causa primaria de la hipertensión endocraneal. Se constata la etiología del traumatismo, el nivel de conciencia inicial mediante la GCS, las lesiones encefálicas en la TC secundarias al traumatismo craneoencefálico según la clasificación de Marshall10 (The National Traumatic Coma Data Bank, TCDB). Así mismo se valoran en todos los pacientes los tratamientos realizados hasta la decisión quirúrgica (en el 50% de los casos se pasó por coma barbitúrico, que no llegó a controlar la HEC) y la duración de los mismos, el nivel máximo que alcanzó la PIC y el mínimo valor de la PPC. Se recoge el momento de realización y tipo de CD (unilateral o bilateral). Para valorar la eficacia del tratamiento quirúrgico se mide la cifra de PIC en la primera hora tras la CD y la necesidad de tratamientos coadyuvantes posteriores para conseguir su control. Para valorar la evolución posterior se recogen los días de intubación y de ingreso en la UCIP. Asimismo se analiza el grado de secuelas al alta de la UCIP a los 6 meses tras el evento, mediante la escala Glasgow Outcome Score (GOS) (exitus: 1; estado vegetativo: 2; secuelas incapacitantes: 3; secuelas no incapacitantes: 4; vida normal sin limitaciones: 5).
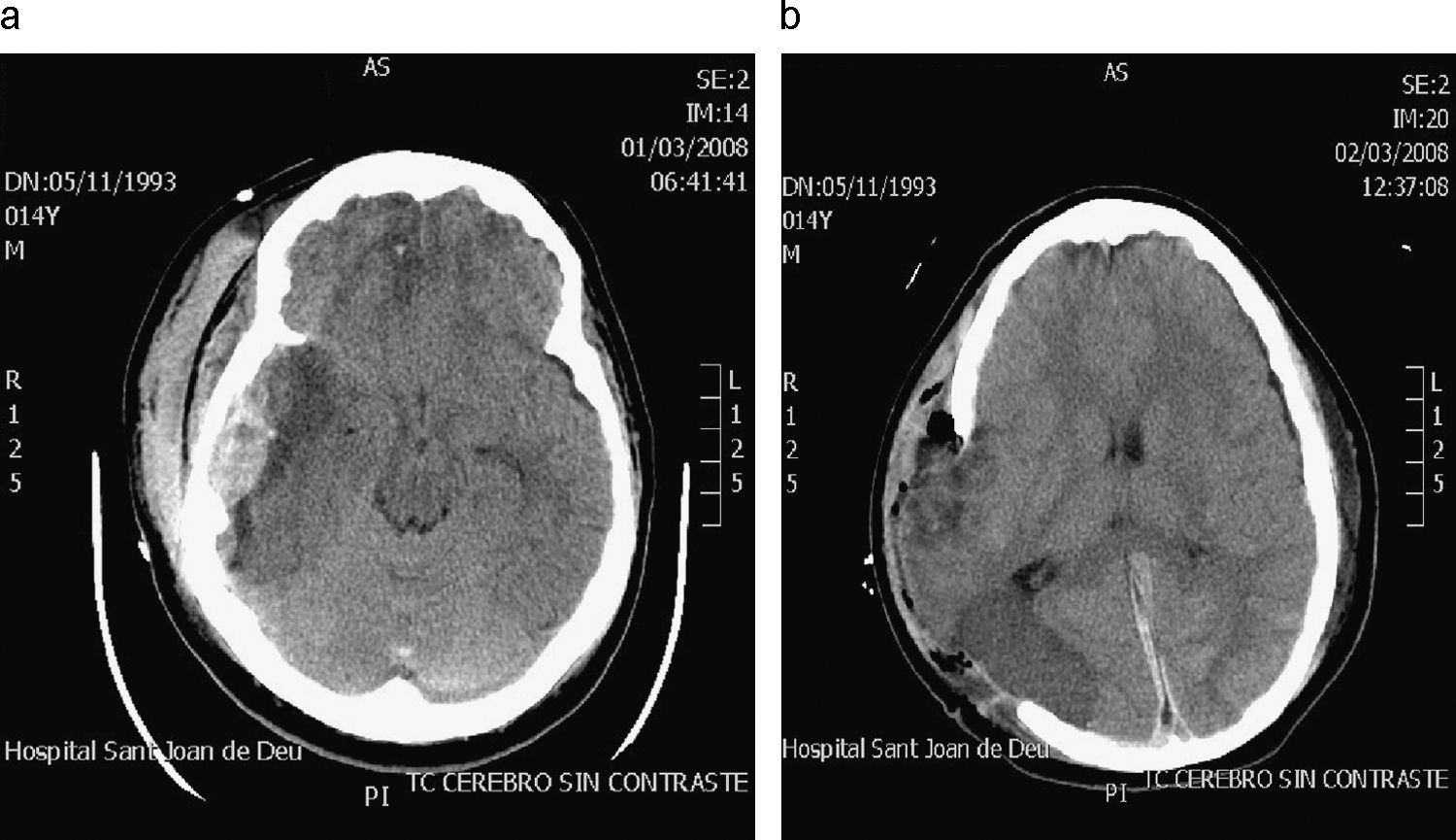
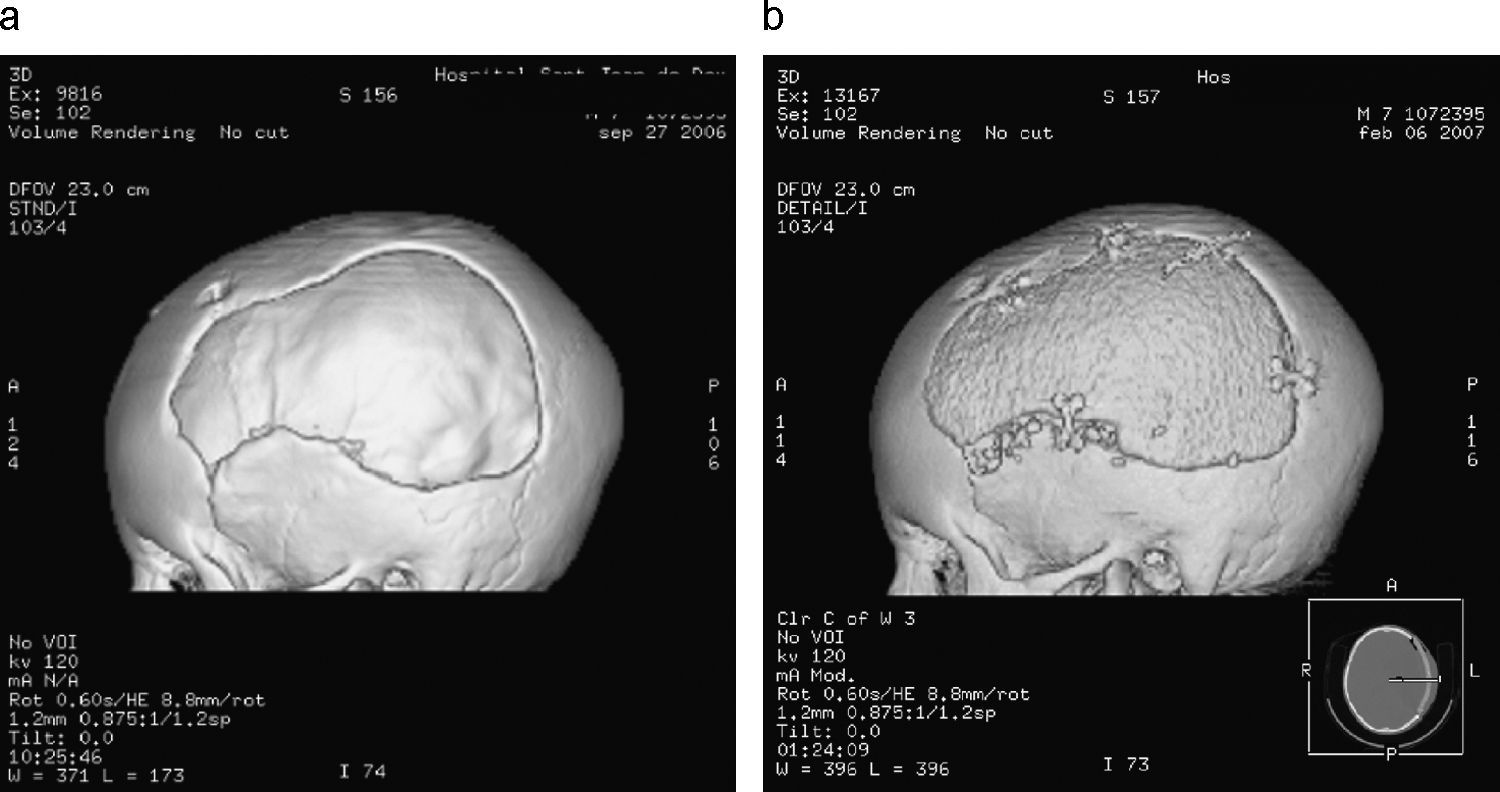
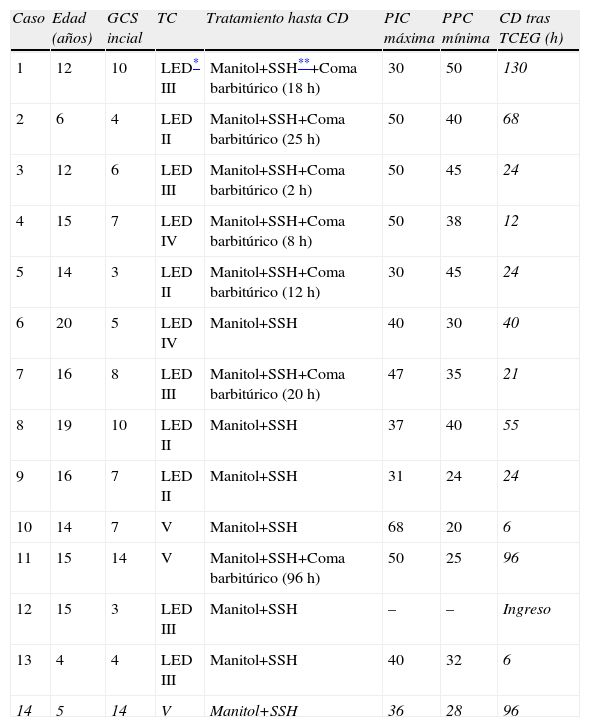
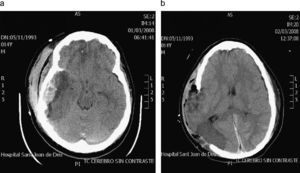
ResultadosSon un total de 14 pacientes que presentan hipertensión endocraneal secundaría a TCEG, 11 varones y 3 mujeres. La mediana de edad es de 14,5 años (rango 4–20 años). En la evaluación inicial presentaron un GCS con un rango entre 3–14 puntos. Las características de los pacientes antes de la CD se reflejan en la tabla 1. En todos se realizó un estudio por neuroimagen mediante TC en el momento de su ingreso en la UCIP. Las lesiones más frecuentes detectadas fueron las lesiones encefálicas difusas (LED) grados II y III que se presentaron en 4 casos cada una de ellas, lo que representa un 28,5% respectivamente. A todos los pacientes se colocó un sensor parenquimatoso para monitorizar la PIC a excepción del paciente 12 y todos presentaron cifras de hipertensión endocraneal mantenida, por encima de 25mmHg, a pesar del tratamiento antihipertensivo endocraneal del primer escalón terapéutico, y en 7 (50%) también tras tratamiento con coma barbitúrico. En todos los casos se realizó una CD para controlar las cifras de PIC y mejorar la PPC. Todas fueron unilaterales frontotemporoparietales con durotomía amplia, excepto el caso 1 en la que la CD fue frontal bilateral (fig. 1). La duramadre se dejó abierta en todos los casos y los defectos meningeos fueron recubiertos con Duraform (Codman, Johnson & Johnson, Raynham, MA., EE.UU.). El colgajo óseo fue desechado en todos los casos, dados los problemas relativos a su conservación, al riesgo de reabsorción y de pérdida de vitalidad del hueso que puede producirse hasta el momento de su reposición. En todos los pacientes, en los meses siguientes, se coloca material protésico de hidroxiapatita realizado a medida mediante TC tridimensional, fijado con tornillos y miniplacas de titanio. En 1 caso se practicó exéresis de focos contusitohemorrágicos con efecto masa (fig. 2).
Características de los pacientes con TCE Grave con HTIC previa a la CD
| Caso | Edad (años) | GCS incial | TC | Tratamiento hasta CD | PIC máxima | PPC mínima | CD tras TCEG (h) |
| 1 | 12 | 10 | LED* III | Manitol+SSH**+Coma barbitúrico (18h) | 30 | 50 | 130 |
| 2 | 6 | 4 | LED II | Manitol+SSH+Coma barbitúrico (25h) | 50 | 40 | 68 |
| 3 | 12 | 6 | LED III | Manitol+SSH+Coma barbitúrico (2h) | 50 | 45 | 24 |
| 4 | 15 | 7 | LED IV | Manitol+SSH+Coma barbitúrico (8h) | 50 | 38 | 12 |
| 5 | 14 | 3 | LED II | Manitol+SSH+Coma barbitúrico (12h) | 30 | 45 | 24 |
| 6 | 20 | 5 | LED IV | Manitol+SSH | 40 | 30 | 40 |
| 7 | 16 | 8 | LED III | Manitol+SSH+Coma barbitúrico (20h) | 47 | 35 | 21 |
| 8 | 19 | 10 | LED II | Manitol+SSH | 37 | 40 | 55 |
| 9 | 16 | 7 | LED II | Manitol+SSH | 31 | 24 | 24 |
| 10 | 14 | 7 | V | Manitol+SSH | 68 | 20 | 6 |
| 11 | 15 | 14 | V | Manitol+SSH+Coma barbitúrico (96h) | 50 | 25 | 96 |
| 12 | 15 | 3 | LED III | Manitol+SSH | – | – | Ingreso |
| 13 | 4 | 4 | LED III | Manitol+SSH | 40 | 32 | 6 |
| 14 | 5 | 14 | V | Manitol+SSH | 36 | 28 | 96 |
CD: cranectomía descompresiva; GCS: Glasgow coma scale; HTIC hipertensión intracraneal; PIC: presión intracraneal; PPC: presión de perfusión cerebral; TCEG: traumatismo craneoencefálico grave.
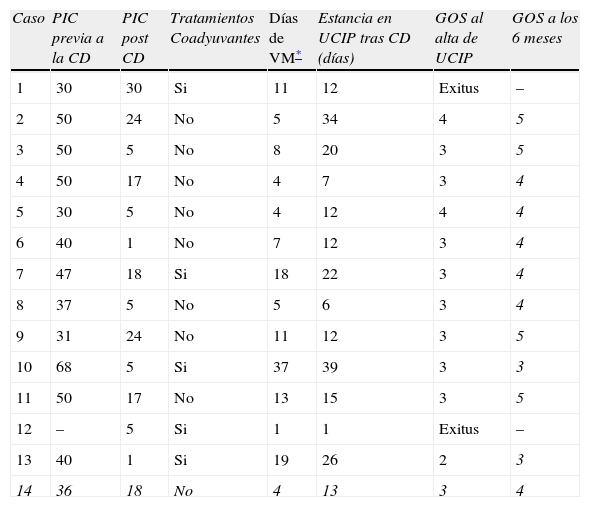
En la tabla 2 se recoge la evolución postquirúrgica. En 9 pacientes (64,3%) se consiguió un buen control de la PIC en las primeras 24h tras la CD sin precisar tratamientos adyuvantes, el resto (5 pacientes; 35,7%) precisaron algún tratamiento adicional (agentes osmóticos, coma barbitúrico o reintervención quirúrgica), la evolución fue favorable en todos los casos salvo en los 2 pacientes (1 y 12) que fallecieron como consecuencia de la hipertensión endocraneal. Los pacientes que sobrevivieron presentaron una mediana de 7,5 días de ventilación mecánica tras la CD (rango 4–37 días), la mediana de estancia en UCIP tras la craniectomía fue de 14 (rango de 6–39 días). En cuanto al pronóstico neurológico, en el momento del alta de UCIP la mediana del GOS fue de 3 (rango 2–4), mientras que a los 6 meses fue de 4 (rango 3–5).
Evolución tras la realización de la CD
| Caso | PIC previa a la CD | PIC post CD | Tratamientos Coadyuvantes | Días de VM* | Estancia en UCIP tras CD (días) | GOS al alta de UCIP | GOS a los 6 meses |
| 1 | 30 | 30 | Si | 11 | 12 | Exitus | – |
| 2 | 50 | 24 | No | 5 | 34 | 4 | 5 |
| 3 | 50 | 5 | No | 8 | 20 | 3 | 5 |
| 4 | 50 | 17 | No | 4 | 7 | 3 | 4 |
| 5 | 30 | 5 | No | 4 | 12 | 4 | 4 |
| 6 | 40 | 1 | No | 7 | 12 | 3 | 4 |
| 7 | 47 | 18 | Si | 18 | 22 | 3 | 4 |
| 8 | 37 | 5 | No | 5 | 6 | 3 | 4 |
| 9 | 31 | 24 | No | 11 | 12 | 3 | 5 |
| 10 | 68 | 5 | Si | 37 | 39 | 3 | 3 |
| 11 | 50 | 17 | No | 13 | 15 | 3 | 5 |
| 12 | – | 5 | Si | 1 | 1 | Exitus | – |
| 13 | 40 | 1 | Si | 19 | 26 | 2 | 3 |
| 14 | 36 | 18 | No | 4 | 13 | 3 | 4 |
CD: cranectomía descompresiva; GOS: Glasgow outcome score; PIC: presión intracraneal; UCIP: unidad decuidados intensivos pediátricos.
La CD fue durante muchos años una técnica controvertida6,9, probablemente por ofrecer malos resultados y considerarse demasiado agresiva. Por el contrario se han venido utilizando hasta la actualidad otras estrategias terapéuticas, como el coma barbitúrico, mucho más fácil de instaurar en el ámbito pediátrico. A pesar de los efectos conseguidos sobre el control de la PIC y en la mejoría del pronóstico de los pacientes tratados avalado por diversos trabajos5,11–14 no pueden olvidarse los efectos adversos que se atribuyen al coma barbitúrico; como la susceptibilidad a las infecciones15, leucopenia y neutropenia reversibles16, y fundamentalmente, la inestabilidad hemodinámica11,17,18. Constatados los posibles efectos secundarios y el riesgo de generar complicaciones en los últimos años se ha limitado el uso del coma barbitúrico19,20 y se ha intentado la utilización de otras opciones terapéuticas de segundo nivel entre las que destaca la recuperación de la CD.
Diferentes estudios han analizado el impacto de la CD en el control de la PIC, aunque la experiencia en niños es limitada. En el único estudio prospectivo y randomizado que incluye 27 niños entre 12 meses y 18 años, Taylor et al9 demuestran que los pacientes a los que se les realizó en las primeras 16h tras el TCEG obtenían cifras inferiores de PIC que el grupo control (3,7 vs 9mmHg). Otros trabajos muestran correlaciones entre la CD y la disminución del nivel de la PIC21–24. En la presente serie se observa una disminución de la PIC desde 41,7mmHg antes de la CD hasta medias de 12,8mmHg tras el procedimiento. En la mayoría de estos pacientes se consiguió un buen control de la PIC tras la CD, de forma que 9 de estos (64,3%) no precisaron tratamientos adyuvantes; en 3 (21,4%) inicialmente la CD no fue suficiente para controlar la HTIC requiriendo agentes osmóticos. Dos pacientes fallecieron como consecuencia de una HTIC refractaria. Respecto a esto cabe comentar el trabajo de Kan et al22 que muestra un peor pronóstico en los sujetos a los que se les ha realizado una CD pero en los que no se produce una disminución de la PIC; en esta serie de 51 pacientes la media de GCS al ingreso fue de 4,6 y la mortalidad del 31,4%, en nuestra serie la media de GCS al ingreso es de 6 puntos, mientras que la mortalidad es del 14,4%.
En un estudio previo25 realizado en nuestro centro antes de la protocolización de la CD se observa que no solo la PIC, sino también la PPC juega un importante papel en el pronóstico final de los pacientes con TCEG; el 70% de los niños con una PPC inicial inferior a 40mmHg fallecen o presentan un peor pronóstico neurológico. Para realizar una comparación con la actuación actual debe admitirse como limitación fundamental la de tratarse evidentemente de un estudio realizado en fechas distintas pero es importante recalcar que el protocolo terapéutico ha permanecido invariable hasta el momento, siendo la única modificación existente la introducción de la craniectomía descompresiva. En la presente serie la PPC media es de 40,8mmHg, existiendo 6 pacientes con PPC por debajo de 40mmHg que presentan una buena evolución a los 6 meses de seguimiento. Cabe comentar el Paciente 1, que presenta una PPC mínima alrededor de 50mmHg y una PIC máxima de 30mmHg antes de la CD, su mala evolución posterior puede estar influenciada por la realización de la técnica demasiado tardía. Parece por tanto que nuestros datos muestran una mejor evolución neurológica en los pacientes con HTIC refractaria a los que se les realiza una CD. Taylor et al9 muestran que el 54% de los pacientes a los a los que se les realizó una CD muestran unas valoraciones al alta por la escala de GOS de 4–5, mientras que solo el 14% del grupo control las presenta. Polin et al23 reporta una serie de 35 pacientes con una edad mediana de 18 años, que muestra la mejor respuesta de los pacientes pediátricos a la CD, ya que en la valoración pronóstica (GOS favorable, de 4–5), los pediátricos representan el 44%, mientras que los adultos el 29%. El 71,4% de los pacientes de nuestra serie presentan una buena evolución neurológica (GOS 4–5) con una media de 4,16 a los 6 meses de la CD.
Respecto a los hallazgos en la neuroimagen, no existen estudios comparativos con respecto al manejo en función de la lesión en la TC craneal, excepto en el estudio publicado por Polin et al23. Si comparamos el grupo de estudio con la cohorte histórica de TCEG de nuestro centro26 (156 pacientes entre los años 1999 y 2004), se encuentra una relación significativa entre los hallazgos en la TC, de acuerdo con el TCDB, y la evolución neurológica mediante el GOS (Glasgow outcome scale. Los pacientes con lesiones cerebrales difusas tipos II, III y IV evolucionan a GOS 1–2 en el 18,7% y a GOS 3 en un 11,6%. A pesar de tratarse de una serie corta en nuestra casuística se aprecia que desde, la utilización de la CD para el control de PIC y PPC, la media del GOS es de 4,16 entre los supervivientes (85,7%), mientras que solo el 14,3% presenta un GOS 1–2 a los 6 meses de seguimiento. Además de la evolución neurológica parece claro que la utilización de la CD disminuye los días de ingreso en la UCIP tal como se recoge en diferentes estudios2,9,19,27. Para este grupo la estancia media en UCIP fue de 17,1 días.
Por otro lado cabe comentar que no existe un consenso en cuanto al momento de la realización de la CD, pero parece que cuanto antes se realice mejor es el pronóstico neurológico. La mayoría de autores aconsejan al cirugía descompresiva en las primeras 48h tras el TCEG5,6,28, aunque parece claro que los valores de PCI y PPC también son importantes para decidir el momento de la CD, de forma que la indicación más precisa seria cuando la PIC se mantiene en valores por encima de 25mmHg y la PPC en valores inferiores a 50mmHg. En el 64,3% de los pacientes de la presente serie se practicó la CD dentro de las primeras 48h. Es esperanzador un nuevo estudio prospectivo, controlado y randomizado como es el RescueICP trial (http://www.rescueicp.com) que intenta aportar evidencia respecto al momento e indicaciones de realización de una CD así como respecto a la evolución posterior de estos pacientes, aunque no incluye pacientes menores de 10 años, y está limitado a pacientes con TCEG.
Respecto al tipo de cirugía cabe destacar que la decisión de realizar una CD uni o bilateral depende de la extensión y distribución de las lesiones. En nuestra serie se realizó una CD unilateral en 13 pacientes, dado que la lesión cerebral estuvo más localizada en un hemisferio y solo en un caso bilateral. Es importante realizar CD extensas; un estudio multicéntrico demuestra que los pacientes con CD mayores a 30cm2 presentan una mejor evolución que los pacientes con CD más pequeñas29. En nuestros pacientes se ha realizado CD como mínimo de 12cm de diámetro. De la misma forma es importante realizar una duroplastia para completar la descompresión, reconstruyendo la duramadre con implantes de colágeno. Esta cirugía no esta exenta de complicaciones. Algunos autores han descrito hidrocefalia postquirúrgica en un porcentaje elevado de pacientes que puede llegar a ser superior al 40%19,23. En nuestra serie no se han presentado casos de hidrocefalia aunque sí se han presentado las siguientes complicaciones (21%): un paciente presentó un hematoma epidural laminar contralateral significativo tras la CD que requirió evacuación quirúrgica. Otro paciente presentó una hemorragia intraventricular que requirió drenaje ventricular externo. Finalmente, un paciente desarrolló un accidente vascular contralateral tardío presentando una buena evolución posterior. Otras complicaciones descritas en la literatura han sido la herniación a través de la zona de la craniectomía, fístula de líquido cefalorraquídeo y hematoma subdural o epidural. Se estima que el 30% de los pacientes a los que se les realiza una CD van a presentar complicaciones, y de estos, un 10% van a presentar secuelas permanentes30.
La principal limitación del trabajo consiste en la ausencia de una randomización que permitiera comparar la craniectomía descompresiva con la utilización de las otras medidas terapéuticas de segundo nivel, en el futuro sería útil el desarrollo de estudios comparativos con la hipotermia, la hiperventilación o el coma barbitúrico (aunque en pediatría, el polimorfismo de los pacientes y las series con escaso número de casos, lo hacen muy difícil). La utilidad del coma barbitúrico parece limitada dados los efectos secundarios descritos como inestabilidad hemodinámica y aumento de la susceptibilidad a las infecciones y que en nuestra experiencia se han presentado en pacientes pediátricos con relativa frecuencia. En relación a la hipotermia y a partir de estudios de adultos, las opciones terapéuticas en niños serían siempre evitar la hipertermia y aunque pueda considerarse la hipotermia como una posibilidad terapéutica, existen trabajos que indican su escasa eficacia y que puede aumentar la mortalidad31.
ConclusiónLos datos obtenidos de nuestra serie, aunque incluyen un número pequeño de pacientes, muestran que la CD es una opción muy interesante en el manejo de la hipertensión intracraneal refractaria en niños y adolescentes. En los pacientes con TCEG se podría usar conjuntamente o como alternativa al coma barbitúrico, especialmente en pacientes hemodinámicamente inestables. Serían necesarios estudios prospectivos y controlados para conocer mejor las indicaciones y la evolución posterior de la craniectomía descompresiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.