Comunicar los valores de óxido nítrico nasal (ONn) en niños con discinesia ciliar primaria (DCP) comparados con los niveles de ONn en niños sanos y en niños afectos de asma, fibrosis quística (FQ) y bronquiectasias pos infecciosas.
Pacientes y métodosSe realizó la determinación de ONn en 9 niños con DCP, 36 niños asmáticos, 31 niños con FQ, 8 niños con bronquiectasias post infecciosas y 37 niños sanos. Se compararon los valores de ONn en las diferentes patologías y se determinó la sensibilidad y la especificidad de la prueba para el diagnóstico de DCP.
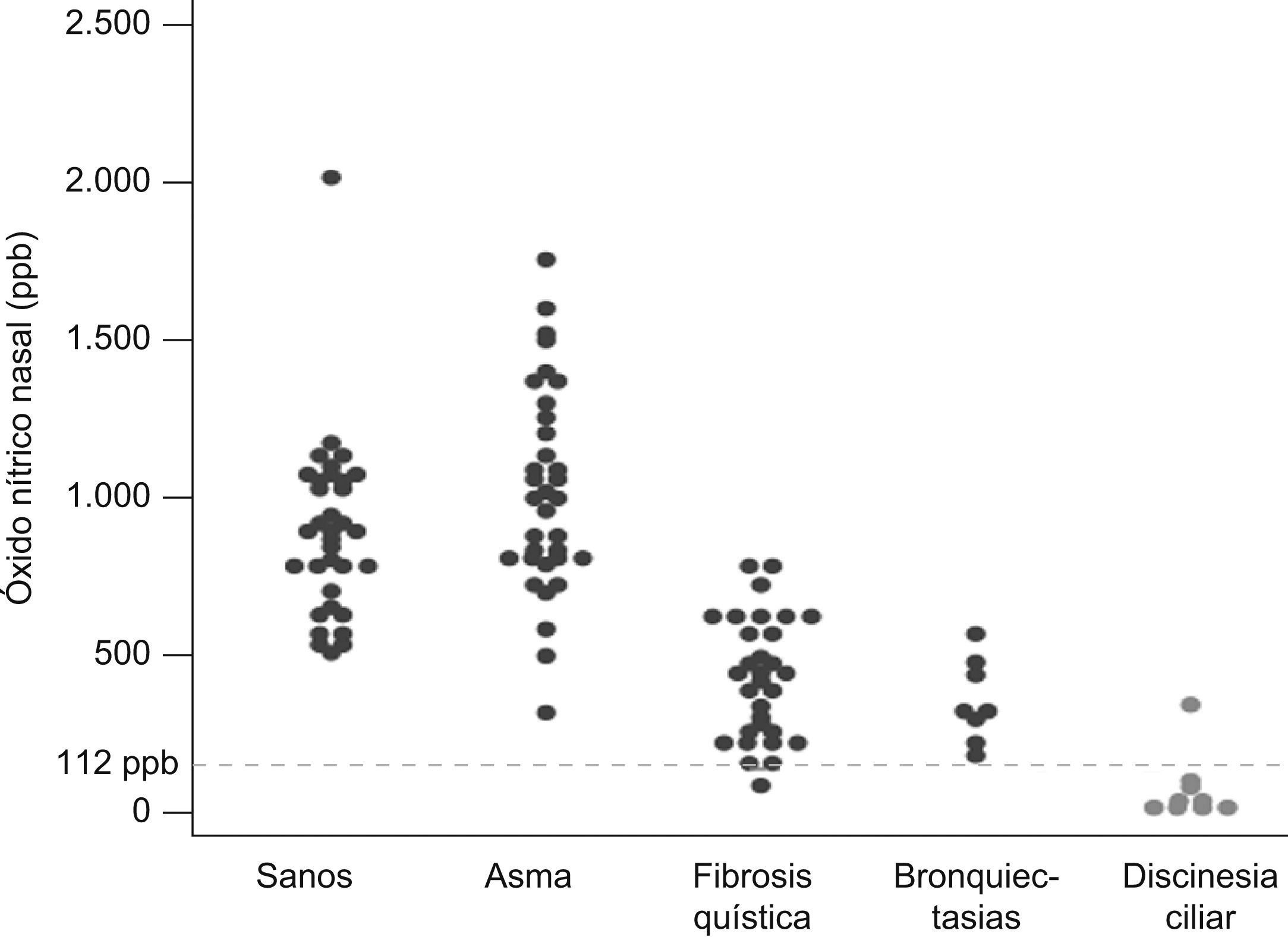
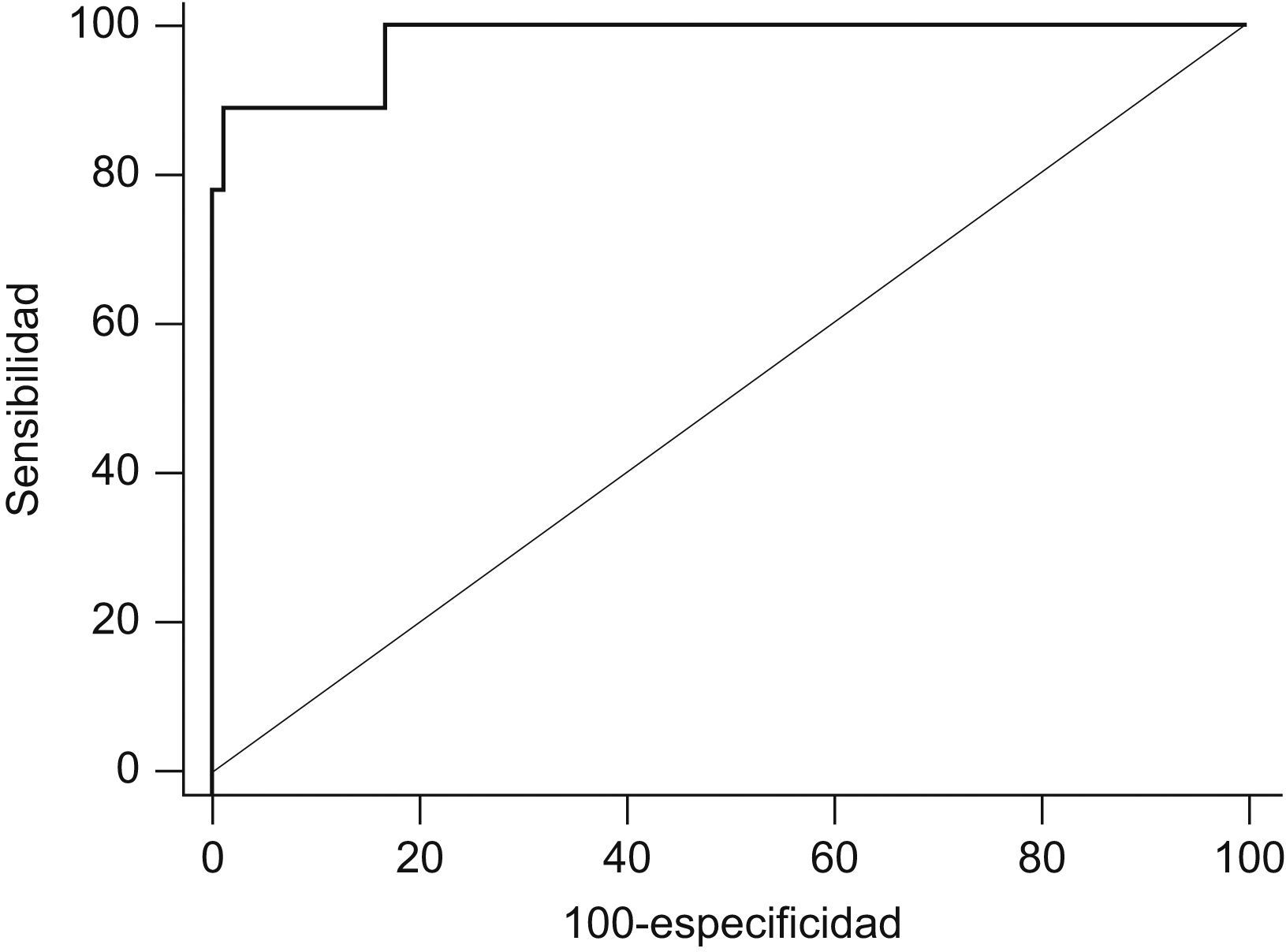
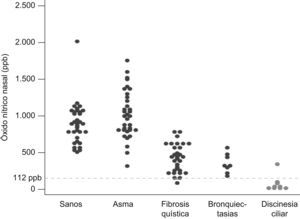
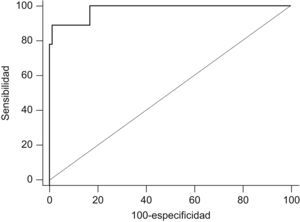
ResultadosTodos los niños con DCP excepto uno (ONn 348 ppb) mostraron un valor de ONn inferior a 112 ppb, siendo la media de 88 ppb (IC95% 9,6–166). En los niños sanos, la media del ONn fue de 898 ppb (IC95% 801–995), en los asmáticos 1023 ppb (IC95% 911–1137), en los niños con FQ 438 ppb (IC95% 367–508) y en los pacientes con bronquiectasias pos infecciosas de 361 ppb (IC95% 252–470). El valor medio de ONn fue significativamente inferior (p<0,05) en los niños afectos de DCP respecto a todos los demás grupos. Un punto de corte de NOn ≤112 ppb mostró una sensibilidad del 88,9% y una especificidad del 99,1% para el diagnóstico de DCP [área bajo la curva ROC 0,98 (IC95% 0,94–0,99); p<0,0001; razón de probabilidad 95,1].
ConclusionesUn valor de ONn ≤ 112 ppb en niños es altamente sugestivo de DCP aunque un valor superior no descarta por completo la enfermedad.
The aim of this study is to report nasal nitric oxide (nNO) values in children with primary ciliary dyskinesia (PCD) and to compare them with nNO values in healthy children, asthmatic children, children with cystic fibrosis and children with post infectious bronchiectasis.
Patients and methodsWe determined nNO values in 9 children with PCD, 36 asthmatic children, 31 children with cystic fibrosis, 8 children with post infectious bronchiectasis and 37 healthy children. We compared nNO values between these different conditions and calculated sensitivity and specificity of nNO to diagnose PCD.
ResultsAll children with PCD - except one (nNO 348 ppb) – had nNO values below 112 ppb, mean 88 ppb (95%CI 9.6–166). The nNO mean was 898 ppb (95%CI 801-995) in healthy children, 1023 ppb (95%CI 911–1137) in asthmatic children, 438 ppb (95%CI 367–508) in cystic fibrosis children and 361 ppb (95%CI 252–470) in children with post infectious bronchiectasis. The mean concentration of nNO was lower (P<0.05) in PCD patients, compared to the other groups. The measurement of nasal NO in our study population showed, at a cut-off level of ≤112 ppb, a sensitivity of 88.9% and a specificity of 99.1% in the diagnosis of PCD [ROC 0.98 (95%CI 0.94–0.99); P<0.0001; probability ratio 95.1].
ConclusionsThe measurement of nasal NO appears to be a useful tool for screening children for PCD, in which a cut-off level of ≤112 ppb suggests the disease, although nNO above 112 ppb does not exclude PCD.
La discinesia ciliar primaria (DCP) es una enfermedad autosómica recesiva, genéticamente heterogénea, que se caracteriza por una disfunción total o parcial de las células ciliadas del organismo entre las que destacan las células de la mucosa de revestimiento del aparato respiratorio. Se ha estimado su incidencia en 1/20.000 recién nacidos vivos. Las principales manifestaciones clínicas de la DCP derivan de la acumulación de las secreciones respiratorias y la sobreinfección bacteriana, ocasionando otitis de repetición, sinusitis y bronquiectasias1,2.
El diagnóstico de la DCP es complejo, siendo necesario ante todo, un alto grado de sospecha clínica. Se han utilizado para su cribado el test de la sacarina3,4 y el test de gotas marcadas con 99mTc-albúmina, depositadas en la nariz5,6, que determinan la alteración del aclaramiento mucociliar nasal, pero presentan una baja especificidad.
El estudio mediante microscopio electrónico de la ultraestructura (brazos de dineína internos y externos) de los cilios de la mucosa respiratoria, a partir de una muestra obtenida mediante cepillado nasal, se considera habitualmente el patrón oro para diagnosticar la enfermedad1. Sin embargo existe el inconveniente de que los contaminantes ambientales y/o las infecciones virales pueden inducir alteraciones en los cilios, por lo que algunos autores7 realizan cultivos de células epiteliales para diferenciar los cambios secundarios en los cilios (que desaparecen cuando crecen las nuevas células) de los primarios. Además las técnicas de imagen mediante vídeo digital de alta velocidad que permiten visualizar la frecuencia y las características del batido ciliar resultan fundamentales para el diagnóstico especialmente en algunos casos en que la ultraestructura puede ser normal1,8. Recientemente se está avanzando en el estudio genético de la DCP a pesar de ser una enfermedad genéticamente heterogénea9 y, en algunos casos, el análisis de las mutaciones podría ser de gran utilidad diagnóstica.
El estudio de la ultraestructura y la motilidad ciliar a partir del cepillado nasal presenta el inconveniente de ser molesto para los pacientes y costoso, tanto a nivel económico como logístico, por lo que parece interesante disponer de un método de cribado que permita seleccionar a los pacientes que precisen esta prueba. En los últimos años, se ha descrito la determinación de los niveles de óxido nítrico nasal como un método prometedor de cribado para la DCP. Diferentes autores han observado niveles muy bajos de NOn en estos pacientes respecto a los controles sanos10–13.
El objetivo de nuestro trabajo es comparar los valores de NOn en pacientes afectos de DCP (diagnosticados por estudio de la ultraestructura de los cilios de la mucosa nasal mediante microscopio electrónico) con los valores de NOn en controles sanos, pacientes asmáticos, pacientes con fibrosis quística y con bronquiectasias postinfecciosas, determinando su sensibilidad y especificidad.
Pacientes y métodosPacientesEstudiamos el ONn en 9 pacientes (4 varones) de 7–14 años de edad, diagnosticados de DCP a partir del estudio de la ultraestructura de los cilios de la mucosa nasal mediante microscopio electrónico, comparando los resultados con niños sanos y pacientes afectos de otras patologías del mismo intervalo de edad, reclutados todos mediante un muestreo de conveniencia.
Se incluyeron 37 niños sanos que no presentaban atopia, patología respiratoria crónica ni infecciones respiratorias recientes (en el último mes) y 36 niños asmáticos con edades entre 6–17 años de las consultas de neumología pediátrica de nuestro centro, 21 con asma episódica ocasional sin tratamiento de mantenimiento y 15 con asma episódica frecuente o moderada persistente en tratamiento con corticoides inhalados. Los pacientes asmáticos no habían presentado ninguna crisis ni habían precisado corticoides orales durante el último mes.
Se compararon también los resultados con niños afectos de fibrosis quística (n=31) reclutados en la Unidad de fibrosis quística de nuestro centro y niños con bronquiectasias postinfecciosas (n=8), en los que se descartó patología de base (inmunodeficiencias, fibrosis quística o discinesia ciliar primaria), con edades entre 6–14 años. Ambos grupos de pacientes se encontraban en situación estable sin presentar una agudización infecciosa.
Medición del óxido nítrico nasalLa medición del NOn se realizó mediante un analizador de quimioluminiscencia (LR 2000, Logan Research, Rochester, UK) siguiendo las recomendaciones de la European Respiratory Society (ERS) Task Force Report14. Se calibró el analizador utilizando NO (200 ppb [parts per billion]).
Para el estudio de la NOn empleamos la siguiente técnica: tras una inspiración a capacidad pulmonar total, el paciente mantiene la respiración a máxima tolerancia y se coloca una tubuladura de Teflón® que obstruye un orificio nasal dejando permeable el otro. El analizador de óxido nítrico aspira aire de forma continua a 250ml/min de la fosa nasal ocluida. Durante la maniobra se controla el CO2 para detectar el mínimo flujo espiratorio. Se aceptó la media de 3 lecturas registradas en la meseta de NOn, si la diferencia entre ellas era menor del 10%.
Datos de los niños sanos y asmáticos se han publicado previamente15, contando el estudio con la aprobación del Comité de Ética del hospital, y la autorización de los participantes.
Análisis estadísticoSe presentan los datos como la media y su IC al 95%.
Se realizó un análisis de la varianza de una vía para comparar las medias, seguido del test de Student-Newman-Keuls de comparaciones múltiples, previa comprobación de la normalidad mediante la prueba de Kolmogorov-Smirnov. Se calculó la sensibilidad, especificidad y el área bajo la curva ROC de los niveles de NOn para el diagnóstico de DCP.
ResultadosNo existieron diferencias significativas en la edad de los pacientes entre los diferentes grupos estudiados.
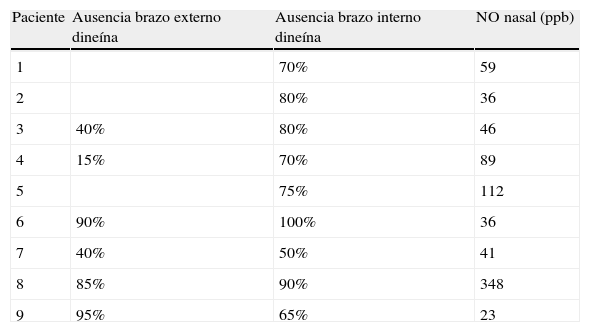
Todos los niños afectos de DCP excepto uno (NOn 348 ppb) mostraron un valor de NOn inferior a 112 ppb, siendo la media de 88 ppb (IC95% 9,6–166). El paciente con NOn más elevado no presentaba rinitis alérgica ni otros signos de atopia. En la tabla 1 se muestran los hallazgos microscópicos en cada paciente y sus valores respectivos de NOn.
Hallazgos de la ultraestructura ciliar y valores de óxido nítrico (NO) nasal en los pacientes afectos de discinesia ciliar primaria
| Paciente | Ausencia brazo externo dineína | Ausencia brazo interno dineína | NO nasal (ppb) |
| 1 | 70% | 59 | |
| 2 | 80% | 36 | |
| 3 | 40% | 80% | 46 |
| 4 | 15% | 70% | 89 |
| 5 | 75% | 112 | |
| 6 | 90% | 100% | 36 |
| 7 | 40% | 50% | 41 |
| 8 | 85% | 90% | 348 |
| 9 | 95% | 65% | 23 |
Del resto de niños estudiados solo un paciente con fibrosis quística presentó un valor de NOn menor a 112 ppb (96ppb).
En los niños sanos, la media del NOn fue de 898 ppb (IC95% 801–995), en los asmáticos 1.023 ppb (IC95% 911–1.137), en los niños con fibrosis quística 438 ppb (IC95% 367–508) y en los pacientes con bronquiectasias postinfecciosas de 361 ppb (IC95% 252–470) (fig. 1).
El valor medio de NOn fue significativamente inferior (p<0,05) en los niños con DCP respecto a todos los demás grupos, siendo además inferior en los niños con bronquiectasias y fibrosis quística respecto a los niños sanos y asmáticos (p<0,05). Entre los pacientes afectos de fibrosis quística y los pacientes con bronquiectasias postinfecciosas no existieron diferencias estadísticamente significativas.
Un punto de corte de NOn≤112 ppb mostró una sensibilidad del 88,9% y una especificidad del 99,1% para el diagnóstico de DCP (área bajo la curva ROC 0,98 [IC95% 0,94–0,99]; p<0,0001; razón de probabilidad 95,1) (fig. 2).
DiscusiónEn nuestro estudio hemos comprobado que la determinación del NOn representa un método de cribado útil para el diagnóstico de DCP en niños, con una elevada sensibilidad y especificidad, para un punto de corte de 112ppb. Los niveles medios de NOn en los niños con DCP fueron un 90% inferiores respecto de los valores medios de los niños normales.
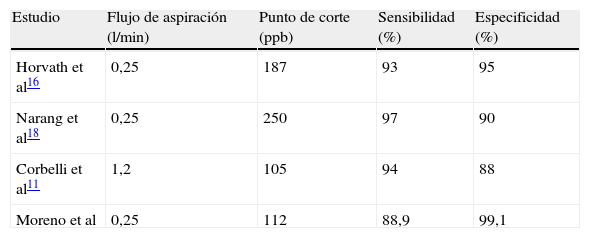
La sensibilidad y especificidad del NOn en el diagnóstico de la DCP, observadas en nuestro trabajo es similar a la de otros estudios en pacientes con bronquiectasias de otra causa (tabla 2). Así, Horváth et al16 con un punto de corte de 187ppb encuentran un 93 y un 95%, respectivamente. Piacentini et al17 comparando solo con controles sanos obtienen para un punto de corte de NOn de 68ppb, una sensibilidad de 100% y una especificidad de 90%, para el diagnóstico de DCP, aunque el valor medio de NOn que obtienen en los niños con DCP (29,7±5,7ppb) es inferior al nuestro (88ppb).
Una de las limitaciones de nuestro estudio es el escaso número de pacientes en el grupo de discinesia ciliar. La realización de nuevos trabajos multicéntricos con mayor número de pacientes y tecnología similar podría ayudar a definir mejor un punto de corte común para los diferentes centros.
Es posible que la medición en el mismo paciente del NOn y de la fracción exhalada del óxido nítrico (FENO) aumente la especificidad de la prueba, cuando la FENO está también disminuida18, y la determinación de la FENO se realiza utilizando un flujo de 50ml/min. En nuestro estudio no pudimos analizar este aspecto al realizarse las mediciones con un medidor con flujo de 250ml/min15, con lo que los valores de FENO se superponen entre los sujetos normales y los afectos de DCP.
Los valores de NOn que hemos observado en las diferentes patologías estudiadas y los que encuentran en otras series pediátricas17,18, son similares a los de población adulta19,20. Esto sugiere que probablemente no existen diferencias en cuanto a los mecanismos que alteran el NOn en las diferentes patologías en niños y adultos.
Se han planteando diferentes hipótesis que justifican la disminución de los niveles de NOn en la DCP. Se ha implicado al óxido nítrico en la regulación positiva de la frecuencia de batido ciliar21, lo que ha hecho que se especule que los niveles bajos de NO en la DCP estén relacionados con el defecto ciliar primario. La sintasa endotelial de óxido nítrico (eNOS) está localizada cerca de la base de los cilios. Esta enzima en el endotelio se activa por el estrés. El movimiento de inclinación de los cilios podría ser el «estrés» que activara la eNOS estimulando la producción de óxido nítrico, que juega un papel en la regulación del movimiento ciliar. La falta de este estímulo se asociaría con la falta o la disminución de la activación de la eNOS y la reducción consecuente de la producción de óxido nítrico en el epitelio de la vía aérea22.
En otras enfermedades como en la fibrosis quística y bronquiectasias de otro origen existen también niveles bajos de NOn, pero superiores a los de la DCP18, aunque en otras series no se alcanza la significación estadística18, como hemos visto en nuestros pacientes. En los pacientes con fibrosis quística se ha descrito una disminución de la expresión de óxido nítrico sintasa en el epitelio bronquial, lo que podría explicar la disminución del NOn23.
En comparación con otras pruebas de cribado de la DCP, la determinación del NOn es una prueba más rentable que el test de la sacarina o que el estudio del transporte mucociliar mediante gammagrafía con albúmina marcada con tecnecio en el que De Boeck et al5 obtienen una sensibilidad de 100% y una especificidad de tan solo 55%. Parece más prometedora una nueva técnica en la que se estudia el aclaramiento mucociliar de todo el árbol respiratorio mediante inhalación de un radioaerosol, determinando su depósito y su eliminación en las vías respiratorias, y midiendo así la función del epitelio ciliado en las vías aéreas inferiores. Su ventaja respecto a los test de sacarina y albúmina marcada es que estos últimos solo evalúan el aclaramiento mucociliar de la región nasal y que permite detectar defectos regionales del aclaramiento mucociliar24.
Se han descrito 2 genes, que intervienen en la síntesis de dineína, cuyas mutaciones se han asociado con la DCP: DNAI1, en el 10% de los casos, y DNAH5, en el 28% de los pacientes9. El estudio de estos genes podría ser de utilidad diagnóstica, especialmente en pacientes con ultraestructura normal.
Más del 60% de los pacientes con DCP no tienen una mutación identificable en ninguno de estos 2 genes, y aunque se han propuesto otras posibles mutaciones, como la de la DNAH11, su relación con la DCP no está todavía totalmente caracterizada9.
En conclusión, la medición del NOn en niños es una prueba no invasora para el despistaje de la DCP, que deberá confirmarse mediante cepillado de la mucosa nasal. Un valor de NOn≤112 ppb es altamente sugestivo de DCP aunque un valor superior no descarta por completo la enfermedad. Creemos que su determinación puede ser un instrumento de apoyo para el diagnóstico, apoyando la indicación de la realización de un cepillado de la mucosa nasal en los casos en que esté disiminuido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.