Determinar el valor diagnóstico de la fracción exhalada del óxido nítrico (FENO) en el asma episódica.
Material y métodosEstudio descriptivo y transversal llevado a cabo en un grupo de pacientes sin antecedentes de patología respiratoria o alérgica (grupo control) y un grupo de pacientes con asma episódica sin tratamiento de base (grupo asma), con edades comprendidas entre los 6 y los 14 años. El protocolo incluyó la medición de la FENO con el analizador portátil NIOX MINO®, seguido de estudio alergológico y espirometría forzada. La repetibilidad de la técnica se analizó con el coeficiente de correlación intraclase, el coeficiente de repetibilidad y el coeficiente de variación. El valor diagnóstico se determinó con la sensibilidad, especificidad, área bajo la curva ROC y la razón de verosimilitud positiva.
ResultadosFueron incluidos 87 pacientes en el grupo control y 57 en el grupo asma. El valor medio±desviación estándar de la FENO en el grupo control fue de 12,1±13,5 ppb y en asmáticos de 42,9±24,5 ppb (p<0,001). El coeficiente de correlación intraclase fue de 0,98 (IC del 95%, 0,96-0,99) y de 0,97 (IC del 95%, 0,92-0,99) en controles y asmáticos, respectivamente; el coeficiente de repetibilidad de 5,5 y 9,2; y el coeficiente de variación (mediana) del 8,3 y el 6,1%. El punto de corte de la FENO que optimizó el valor de la sensibilidad y especificidad (el 91,4 y el 87,2%, respectivamente), fue de 19 ppb, con un área bajo la curva ROC de 0,93 (IC del 95%, 0,88-0,97) (p<0,001) y una RVP de 7,1. La sensibilización subclínica a neumoalérgenos fue la principal causa de falsos positivos.
ConclusionesLa determinación de la FENO con NIOX-MINO® tiene una adecuada repetibilidad, especialmente en los pacientes sanos. En los asmáticos sería recomendable obtener el promedio de dos mediciones. La prueba posee un alto valor diagnóstico en el asma episódica. La sensibilización subclínica a neumoalérgenos puede elevar la FENO hasta niveles patológicos.
To assess the diagnostic value of fractional exhaled nitric oxide (FENO) in mild asthma.
Material and methodsCross-sectional descriptive study in a group of patients with no history of respiratory or allergic illness (control group) and a group of patients with a history of mild asthma with no baseline treatment (asthma group), both aged 6 to 14 years. The following examinations were performed: measurement of FENO using the portable NIOX MINO® device, allergy tests and spirometry. Repeatability of paired FENO measurements was estimated with the intraclass correlation coefficient, the repeatability coefficient and the variation coefficient. The diagnostic value was assessed with the sensitivity, specificity, area under the ROC curve and positive likelihood ratio (LR+) for each cut-off point.
ResultsEighty-seven patients were included in the control group and 57 in the asthma group. The mean FENO value was 12.1 ppb (SD 13.5) in the control group and 42.9 ppb (SD 24.5) in asthmatics (P<.001). The intraclass correlation coefficient was 0.98 (95% CI: 0.96-0.99) and of 0.97 (95% CI: 0.92-0.99) in controls and asthmatics, respectively. The repeatability coefficient was 5.5 in controls and 9.2 in asthmatic children, and the median variation coefficient was 8.3% and 6.1%. The optimal cut-off value for FENO was 19 ppb (sensitivity and specificity were 91.4% and 87.2%, respectively). The area under the ROC curve was 0.93 (95% CI: 0.88-0.97) (P<.001) and the LR+ was 7.1. Subclinical sensitisation to pneumoallergens accounted for most false positive cases.
ConclusionsThe determination of FENO with NIOX MINO® has an adequate repeatability, especially for healthy patients. For asthmatic patients we recommend determining the average of two measurements. The test has a high diagnostic value in mild asthma. Subclinical sensitisation to pneumoallergens can cause the FENO value to rise to pathologic levels.
En los últimos años, la determinación de la fracción exhalada del óxido nítrico (FENO) ha demostrado ser una herramienta útil en el diagnóstico del asma, en el seguimiento clínico y en la comprobación del cumplimiento farmacológico, así como en el ajuste del tratamiento antiinflamatorio1,2. Su importancia queda patente en la última actualización de la Guía española para el manejo del asma (GEMA 2009), que incluye la medición de la FENO en el algoritmo diagnóstico de la enfermedad y recomienda considerar su empleo en el seguimiento del niño asmático3.
La mayor parte de los estudios en los que ha sido evaluado el papel de la FENO, incluidos aquéllos que han aportado valores de referencia en poblaciones de niños sanos, han empleado equipos de medición basados en analizadores de quimioluminiscencia. El principal inconveniente de éstos es su complejidad y su coste, que limita su accesibilidad a algunos centros. Recientemente, se ha llevado a cabo la elaboración y comercialización de equipos portátiles, que se basan en analizadores electroquímicos. Con ellos se simplifica el manejo de la medición de la FENO en la práctica clínica, lo que permite realizar las determinaciones incluso en atención primaria4. El sistema portátil NIOX-MINO® cumple las recomendaciones para las mediciones de la FENO publicadas por la ATS/ERS5. Se ha demostrado que los valores de la FENO obtenidos con este equipo tienen una buena correlación con los obtenidos por quimioluminescencia6–10.
Hasta el momento no existe en la literatura médica ningún trabajo que haya estudiado los valores de referencia de la FENO obtenidos mediante NIOX-MINO® en una población amplia de niños sanos. Además, los escasos trabajos realizados en la edad pediátrica con este analizador, no incluyen información paralela sobre pruebas de función respiratoria o sensibilización a alérgenos. Por otro lado, aunque el fabricante sugiere que una medición de la FENO puede ser suficiente, en niños apenas hay publicados estudios de repetibilidad llevados a cabo con NIOX-MINO®. Tampoco está establecido el grado de solapamiento de los resultados de la FENO entre niños sanos y asmáticos con este equipo de medición. Para ello, son necesarios estudios de sensibilidad y especificidad de la técnica con distintos puntos de corte de la FENO, basados en poblaciones homogéneas en cuanto a edad, gravedad del asma y condición de atopia.
Por estos motivos, nos planteamos estudiar la repetibilidad de las mediciones de la FENO con NIOX-MINO® en niños sanos y asmáticos, y el valor diagnóstico de esta prueba en el asma episódica.
Material y métodosDiseñoEstudio descriptivo transversal con recogida de datos prospectiva. Todos los casos fueron incluidos de forma consecutiva entre septiembre de 2009 y septiembre de 2010. El proyecto fue aprobado por la comisión de investigación del Hospital Universitario de La Ribera (Alzira, Valencia).
Pacientes- –
Grupo asma: niños de entre 6 y 14 años con asma episódica y sensibilización a neumoalérgenos constatada, controlados en la consulta de neumología pediátrica del Hospital Universitario de La Ribera. El diagnóstico de asma se basó en la historia clínica (episodios recurrentes de tos, sibilancias y/o dificultad respiratoria con buena respuesta al tratamiento broncodilatador) y en las pruebas de función pulmonar11. En el 68% de los casos había constancia de una prueba broncodilatadora positiva. Se ha incluido a pacientes cuyo estadio de asma en los dos últimos años haya sido exclusivamente episódica ocasional o episódica frecuente, según la clasificación del consenso español del asma pediátrico11 (tabla 1). Se ha excluido a pacientes con patología neurológica grave asociada, malformaciones mayores o proceso infeccioso agudo. Además, el niño debía permanecer al menos dos semanas libre de agudizaciones y sin empleo de broncodilatadores, y al menos un mes sin tratamiento antiinflamatorio (glucocorticoides inhalados y/o sistémicos y/o montelukast). La incorporación al estudio fue según orden cronológico de citación a consultas externas de neumología, y las pruebas se efectuaron como parte del seguimiento habitual del paciente asmático.
Tabla 1.Clasificación del asma en el niño
Episódica ocasional Episodios de pocas horas o días de duración < 1 vez cada 10-12 semanas Máximo 4-5 crisis al año Asintomático en las intercrisis con buena tolerancia al ejercicio Exploración funcional respiratoria Normal en las intercrisis (FEV1 > 80%, variabilidad PEF < 20%) Episódica frecuente Episodios < 1 vez cada 5-6 semanas Máximo 6-8 crisis al año Sibilancias a esfuerzos intensos Intercrisis asintomáticas Exploración funcional respiratoria Normal en las intercrisis (FEV1 > 80%, variabilidad PEF < 20%) Persistente moderada Episodios > de 1 vez cada 4-5 semanas Síntomas leves en las intercrisis Sibilancias a esfuerzos moderados Síntomas nocturnos ≤ 2 veces por semana Necesidad de agonistas β2≤ 3 veces por semana Exploración funcional respiratoria FEV1 entre el 70% y el 80% del valor predicho Variabilidad del PEF entre el 20-30% Persistente grave Episodios frecuentes Síntomas en las intercrisis Sibilancias a esfuerzos mínimos Síntomas nocturnos > 2 veces por semana Necesidad de agonistas β2> 3 veces por semana Exploración funcional respiratoria FEV1 < 70% del valor predicho Variabilidad del PEF > 30% FEV1: volumen espiratorio forzado en el primer segundo; PEF: flujo espiratorio máximo. Tomado de: Castillo et al11.
- –
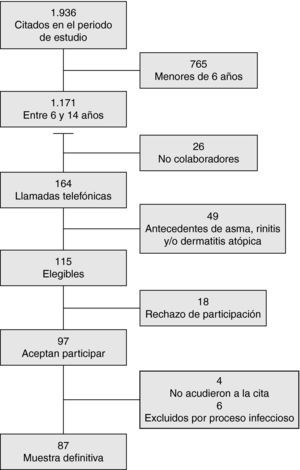
Grupo control: niños de entre 6 y 14 años sin antecedentes de patología respiratoria y/o alérgica que acuden a visitas programadas a las consultas externas de pediatría. Se ha excluido a pacientes con patología neurológica grave, malformaciones mayores, proceso infeccioso agudo o tratamiento con corticoides sistémicos. Se escogió un día a la semana para la selección de los pacientes elegibles y se entrevistó telefónicamente a los padres por orden de citación, 2 semanas antes de la visita programada a consultas externas de especialidades pediátricas. Se les realizó un cuestionario basado en el International Study of Asthma and Allergies in Childhood sobre antecedentes de asma, rinitis y dermatitis atópica12. Tras descartar estas patologías, a todos los pacientes se solicitó el consentimiento informado.
NIOX-MINO® (Aerocrine, Solna, Suecia) es un analizador electroquímico ligero (800g) y de pequeño tamaño (24 x 13 x 10cm). Su margen de lectura es entre 5 y 300 ppb. Se trata de una técnica menos precisa que el analizador de quimioluminiscencia estacionario, reproducible y únicamente de representación digital.
El procedimiento consiste en realizar una inhalación a través de la boquilla del aparato hasta capacidad pulmonar total, seguida de una exhalación con flujo espiratorio de 50ml/s durante 6 segundos13 con una presión entre 5 y 20cm de H2O. La exhalación es controlada por un sensor lumínico y acústico para facilitar y asegurar el flujo. Además, el niño visualiza el sensor lumínico al situarse frente a un espejo. El resultado aparece de forma digital en la pantalla apenas 2min después de finalizar la exhalación. Se realizan tantos intentos como sea necesario hasta conseguir una determinación válida. Para el estudio de la repetibilidad de la prueba, se realizó una segunda determinación dentro de los 5min posteriores a la primera. Como valor de la FENO de estos pacientes se tomó el promedio de las 2 determinaciones.
La prueba siempre se llevó a cabo en la misma ubicación y con el mismo equipo, verificando previamente que la concentración de NO ambiental fuera inferior a 5 ppb. Las mediciones las realizaron dos investigadores (médico y enfermera) y se efectuaron con el niño sentado y sin pinza nasal, según las recomendaciones de la ATS/ERS5. Se exigió que el niño no hubiera ingerido alimentos ni bebidas ni practicado ejercicio al menos 1h antes de las determinaciones.
Por debajo del margen mínimo de lectura, la pantalla indica «<5 ppb». En estos casos, se optó por asignar de forma arbitraria el valor de 2,5 ppb.
Determinación cualitativa de la IgE específica frente a neumoalérgenos mediante el método ImmunoCAP® RapidImmunoCAP® Rapid (Phadia, Uppsala, Suecia) es una técnica de diagnóstico in vitro, cualitativa, que permite la detección rápida de sensibilización mediada por IgE frente a determinados alérgenos, con una muestra de sangre capilar obtenida por punción del pulpejo del dedo14–16. La batería empleada en el estudio incluye los siguientes alérgenos: ácaros, Alternaria, polen de parietaria, olivo, artemisia, abedul y hierba timotea, epitelios de gato y perro, y cucaracha. La prueba fue realizada en todos los pacientes del grupo sin antecedentes de patología alérgica y/o respiratoria. En el grupo de pacientes asmáticos, fue llevada a cabo únicamente en caso de no disponer de un estudio alergológico previo, o si habían transcurrido más de 2 años desde que se realizó.
Espirometría basal forzadaSe empleó el espirómetro portátil Datospir Micro A® (Sibelmed, Barcelona), con transductor de flujo de tipo turbina que cumple con las recomendaciones de la ATS/ERS17. El aparato acepta como mejor maniobra aquella en que la suma del volumen espiratorio forzado en el primer segundo (FEV1) y la capacidad vital forzada (FVC) alcanza un mayor valor. La espirometría se realizó según la normativa de la Sociedad Española de Neumología Pediátrica18.
Dado que se ha demostrado que los valores de la FENO pueden disminuir discretamente tras la realización de la espirometría19, las pruebas siempre se realizaron siguiendo estrictamente el orden descrito.
Análisis de los datosLas variables cuantitativas se han expresado como media±desviación estándar (DE) o como mediana con el intervalo de valores o el intervalo intercuartílico (IQ). Las variables cualitativas se han expresado como porcentajes. Para la comparación de medias se empleó la prueba de la t de Student y para la comparación de proporciones la prueba de la chi al cuadrado de Pearson. La repetibilidad de la medida de la FENO se determinó con el coeficiente de correlación intraclase (CCI), el coeficiente de variación (CV) y el coeficiente de repetibilidad (CR) mediante el método gráfico de Bland y Altman20 (CR=±1,96 x DE de la distribución de las diferencias entre cada par de mediciones). El valor diagnóstico de la FENO fue estimado mediante el cálculo de la sensibilidad (S) y especificidad (E) y la razón de verosimilitud positiva (RVP). Se construyó una curva de rendimiento diagnóstico (ROC) y se calculó el área bajo la curva (ABC). Para el análisis se ha empleado el paquete estadístico SPSS versión 15.0 para Windows. Se estableció como significativo un valor p<0,05.
ResultadosEl grupo asma está compuesto por 57 niños con asma episódica (70% varones), con un promedio de edad de 10,4 años (6,6-14) y un tiempo medio de evolución de la enfermedad±DE de 6,7±3,4 años. El 46% de ellos presentaba rinitis asociada. El 57% había recibido inmunoterapia o la estaba recibiendo al inicio del estudio.
El grupo control está compuesto por 87 niños (47% varones), con un promedio de edad de 10,4 años (6,3-14). La figura 1 refleja el diagrama de inclusión de los pacientes. En el 15% de las mediciones realizadas en este grupo, se obtuvo un resultado de la FENO menor de 5 ppb. El estudio alergológico fue positivo en 10 pacientes; 6 de ellos estaban sensibilizados a los ácaros del polvo, 2 lo estaban a los hongos y 2 estaban polisensibilizados.
La tabla 2 muestra las principales variables descriptivas de ambos grupos, incluidos los parámetros de función pulmonar. Aunque hubo una diferencia estadísticamente significativa en el cociente FEV1/FVC a favor del grupo control, ésta carece de relevancia clínica.
Principales variables descriptivas y análisis comparativo entre ambos grupos
| Media±DE | p | ||
| Grupo asma (n=57) | Grupo control (n=87) | ||
| Edad (años) | 10,4±2,1 | 10,4±2,1 | 0,9 |
| Peso (kg) | 39,4±12,7 | 40,4±13,9 | 0,7 |
| Talla (cm) | 141,0±12,4 | 140,9±14,7 | 0,9 |
| SC (m2) | 1,2±0,2 | 1,2±0,3 | 0,7 |
| FEV1 (l) | 2,0±0,5 | 2,0±0,6 | 0,6 |
| FVC (l) | 2,5±0,7 | 2,4±0,7 | 0,3 |
| FEV1/FVC (%) | 82,4±8,8 | 88,5±6,4 | < 0,01 |
| Intentos FENO | 2,5±1,7 | 2,8±2,1 | 0,4 |
El promedio del valor de la FENO en pacientes asmáticos y controles fue respectivamente de 42,9±24,5 ppb y 12,1 ± 13,5ppb (p<0,001). En el grupo de pacientes asmáticos, el promedio del valor de la FENO en varones y mujeres fue, respectivamente, de 45,6±27,5 y 36,2±13,8 ppb; en el grupo de pacientes sanos de 10,9±9,6 y 13,8±16,3 ppb. En ambos casos las diferencias no fueron estadísticamente significativas.
RepetibilidadEl estudio de la repetibilidad se efectuó en una muestra de 32 niños asmáticos y en 50 niños del grupo control.
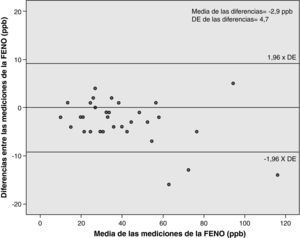
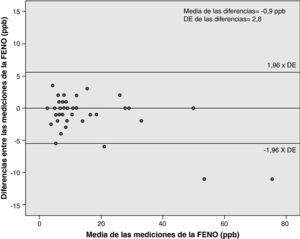
La tabla 3 muestra los valores del CCI, CV y CR en los dos grupos de pacientes y en su conjunto. Se han adjuntado los valores de la DE entre cada par de mediciones. Las figuras 2 y 3 reflejan el valor del CR según el método de Bland y Altman en asmáticos y controles. Este valor permite estimar que, hasta en el 95% de los casos, la diferencia entre cada par de mediciones de la FENO no superará estos límites.
Repetibilidad de las mediciones de la FENO con NIOX-MINO®
| Grupo asma (n=32) | Grupo control (n=50) | Global (n=82) | |
| CCI (IC del 95%) | 0,97 (0,92-0,99) | 0,98 (0,96-0,99) | 0,98 (0,97-0,99) |
| p<0,001 | p<0,001 | p<0,001 | |
| CVa (%) | 6,1 (0-18,9) | 8,3 (0-74,1) | 7,1 (0-74,1) |
| CR (ppb) | ±9,2 | ±5,5 | ±7,4 |
| DEb | 2,1 (0,9-3,5) | 0,7 (0-1,4) | 1,4 (0,7-2,7) |
DE:desviación estándar; CCI:coeficiente de correlación intraclase; CV:coeficiente de variación; CR:coeficiente de repetibilidad.
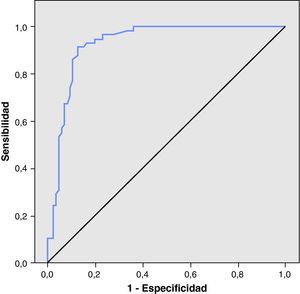
La figura 4 muestra la curva ROC construida a partir de los valores de la FENO obtenidos. El punto de corte que maximizó el valor de la S y la E de la prueba fue 18,75 ppb (S=91,4%; E=87,2%; tabla 4). Dado que el analizador ofrece valores enteros, se ha tomado como punto de corte entre un resultado normal y patológico el valor de 19 ppb. Según éste, en el estudio ha habido un total de 11 resultados falsos positivos y 5 falsos negativos. En el grupo de falsos positivos, 7 pacientes tenían una sensibilización subclínica a neumoalérgenos, con valores de FENO entre 26 y 75 ppb. No hubo diferencias significativas en los parámetros de espirometría en relación con el resto de los niños sanos. Los resultados falsos negativos oscilaron entre 10 y 18 ppb. No hubo diferencias significativas en los parámetros de espirometría en relación con el resto de los niños asmáticos.
Valor de la sensibilidad y especificidad del NIOX-MINO® para diferentes puntos de corte de la FENO
| Valor de la FENO (ppb) | Sensibilidad (%) | Especificidad (%) |
| 17,25 | 93,1 | 83,7 |
| 18,25 | 91,4 | 84,9 |
| 18,75 | 91,4 | 87,2 |
| 19,50 | 89,7 | 87,2 |
| 20,50 | 87,9 | 87,2 |
| 21,25 | 86,2 | 89,5 |
| 21,75 | 84,5 | 89,5 |
| 23,25 | 82,8 | 89,5 |
En negrita aparece reflejado el punto de corte que maximiza este valor.
El ABC fue de 0,93 (IC del 95%, 0,88-0,97) (p<0,001). Este resultado significa que un niño seleccionado aleatoriamente del grupo de los asmáticos tendrá el 93% de las veces un valor de FENO mayor que un niño elegido al azar del grupo de los sanos. El valor de la RVP fue de 7,1, lo que indica que en el grupo de pacientes asmáticos la probabilidad de encontrar un resultado de FENO patológico es 7,1 veces superior que en el grupo de pacientes sanos.
DiscusiónRepetibilidadLas mediciones de la FENO han mostrado una adecuada repetibilidad en la población estudiada, especialmente en los niños sanos. Los resultados son similares a los obtenidos en otros estudios con NIOX-MINO®. En el de McGill et al6, en un grupo de niños sanos y asmáticos, la mediana del CV de las mediciones de la FENO fue del 7,4% (0-44,6). Alving et al8 emplearon la DE entre las mediciones para valorar la repetibilidad de la técnica en 71 pacientes, de 6 a 60 años de edad, sanos y atópicos (con asma y sin asma). La mediana de la DE fue de 1,2 ppb (IQ 0,6-2). Takalo et al21 estudiaron a 166 adultos con asma. El CR en el conjunto de la muestra fue de 2,4 ppb. Sin embargo, observaron que las diferencias entre las mediciones aumentaban según lo hacían los valores de la FENO. Concluyeron que, para valores de la FENO dentro de la normalidad, podría ser suficiente realizar una única determinación en los controles rutinarios; en cambio, para valores en rango patológico es más fiable obtener la media de dos determinaciones. Coincidimos con estos autores en que en pacientes con valores de FENO más elevados (en nuestro caso los asmáticos) es recomendable obtener el promedio de dos mediciones. Si se optara por realizar una única determinación en los controles rutinarios, habría que considerar que una diferencia de hasta 9-10 ppb entre una visita y otra podría deberse a la propia variabilidad del método de medición.
La normativa de la ATS/ERS5 recomienda obtener al menos dos mediciones de FENO, con una diferencia no superior al 5% entre ambas. No obstante, cuando esta normativa fue publicada, el analizador electroquímico aún no había sido comercializado. Según McGill et al6, esta recomendación no se puede asumir para valores de FENO bajos (2 mediciones de 6 y 7 ppb no serían aceptables según la normativa; en cambio la diferencia clínica no es relevante). Además, NIOX-MINO® no muestra cifras decimales, lo cual impide conocer de una manera más precisa la diferencia entre las mediciones. En espera de una normativa actualizada que se pronuncie al respecto de los analizadores electroquímicos, podría ser razonable realizar una única determinación de la FENO en los pacientes sanos.
Los estudios realizados con analizadores de quimioluminiscencia también obtienen unos resultados de repetibilidad satisfactorios22–24. No obstante, el menor coste y la mayor simplicidad del analizador electroquímico hacen preferible su empleo en determinados ámbitos asistenciales, como la atención primaria y los hospitales secundarios.
Sensibilidad y especificidadEl punto de corte de la FENO que mejor ha discriminado entre pacientes sanos y asmáticos es de 19 ppb, con una elevada S y E. Este valor entra dentro del intervalo de normalidad sugerido por Taylor et al25 con analizadores de quimioluminiscencia (5-20 ppb).
Ningún estudio había analizado previamente el valor diagnóstico de la FENO con NIOX-MINO® en la edad pediátrica. En adultos, Schneider et al26 obtuvieron una S del 90% para un punto de corte de 12 ppb y una E del 93% para un punto de corte de 46 ppb en una muestra de 160 pacientes. El ABC fue de 0,64 (IC del 95%, 0,56-0,73), lo que indica una menor capacidad discriminativa que en nuestro estudio, probablemente condicionada por la heterogeneidad de la muestra (diferentes grados de asma, con o sin atopia, pacientes con enfermedad pulmonar obstructiva crónica y pacientes en los que coincidían ambas enfermedades). Por otro lado, Menzies et al7 realizaron un estudio comparativo entre NIOX® (analizador de quimioluminiscencia) y NIOX-MINO® en 151 pacientes sanos y asmáticos. La S fue del 83,2% y la E del 72%, empleando un punto de corte de 13 ppb para el NIOX® y de 12,5 ppb para el NIOX-MINO®. El ABC fue, respectivamente, de 0,65 (IC del 95%, 0,56-0,74) y de 0,62 (IC del 95%, 0,52-0,71). Los autores atribuyen este bajo poder discriminativo al hecho de que más de la mitad de los pacientes asmáticos estaba recibiendo tratamiento con corticoides, lo que sin duda pudo disminuir los valores de la FENO. Además, el estudio no hace mención a la existencia de sensibilización a alérgenos en ninguno de los grupos, circunstancia que también puede influir en los resultados.
Análisis de falsos positivosOtros estudios también han descrito el hallazgo de valores elevados de la FENO en pacientes sanos con sensibilización a alérgenos27–32. En el de Malmberg et al31, llevado a cabo para establecer valores de referencia de la FENO con analizador de quimioluminiscencia, el 45% de los niños fueron excluidos del análisis tras detectarse sensibilización a inhalantes. De ellos, el 20% reconoció no haber presentado nunca síntomas respiratorios u otros relacionados con alergia. Al compararlos con los pacientes sanos no sensibilizados, la FENO fue significativamente superior en los sensibilizados (14,6 vs 10,3 ppb) (p=0,005). Concluyeron que, antes de establecer los valores de normalidad de la FENO en la población, este subgrupo de pacientes debería ser identificado y excluido del análisis, por la influencia que puede tener sobre los resultados. En el estudio de Prasad et al28 los niños atópicos sin síntomas también presentaron una FENO significativamente mayor que los niños no atópicos sin síntomas (15,3 vs 6,9 ppb) (p<0,05). En sus conclusiones, plantean la hipótesis de que los niños asintomáticos con atopia y niveles elevados de FENO, podrían tener un riesgo aumentado de desarrollar asma en edades posteriores28.
Respecto a los 4 niños de nuestro estudio no sensibilizados a inhalantes y con niveles de FENO elevados, no existe una clara explicación que justifique los resultados. Podrían estar sensibilizados a otros alérgenos no incluidos en la batería de Immunocap® Rapid, aunque es poco probable ya que ésta incluye los más prevalentes en la población. Es muy difícil determinar si estos niños también tienen un riesgo aumentado de asma en la edad adulta, si la FENO es un marcador precoz de atopia o si se trata de valores elevados sin un significado patológico. Sólo los estudios longitudinales podrían aclarar estas cuestiones.
Análisis de falsos negativosSe ha comprobado que los falsos negativos no difieren del resto de los pacientes asmáticos del estudio en ninguna variable que pudiera condicionar los resultados: edad y tiempo de evolución del asma, sensibilización a neumoalérgenos, rinitis asociada, inmunoterapia, tiempo sin tratamiento antiinflamatorio o parámetros de espirometría. No encontramos una causa que explique por qué estos pacientes, con base atópica constatada y sin tratamiento de base, presentaron una FENO normal. El buen control clínico del asma no es suficiente motivo, puesto que la mayor parte de los pacientes asmáticos estaban bien controlados. Ricciardolo et al32 han puesto de manifiesto que en niños escolares, con asma alérgica y antecedentes de prematuridad y patología respiratoria con ventilación mecánica al nacimiento, los valores de la FENO están dentro del rango de la normalidad. Podría deberse a que la inmadurez, unida al daño pulmonar asociado a la ventilación mecánica, condiciona una disminución de la actividad de la isoforma inducible de la enzima óxido nítrico sintetasa. A excepción de un paciente, se ha descartado que los falsos negativos de nuestro estudio tuvieran este antecedente. Pijnenburg et al1 advierten que existen pacientes con criterios clínicos y funcionales de asma que presentan una FENO normal, y que esta circunstancia no excluye bajo ningún concepto el diagnóstico de asma. En lo que respecta a nuestro estudio, consideramos necesario un seguimiento evolutivo de la FENO en los pacientes con resultados falsos negativos, con objeto de averiguar si se trata de un hallazgo transitorio o si muestran valores bajos de forma permanente.
En conclusión, la determinación de la FENO mediante el analizador portátil NIOX-MINO® tiene una adecuada repetibilidad, especialmente en los pacientes sanos. En los pacientes asmáticos sería aconsejable obtener el promedio de dos mediciones. La prueba posee un alto valor diagnóstico en el asma episódica, expresado en términos de sensibilidad y especificidad. La sensibilización subclínica a alérgenos inhalantes puede dar lugar a una elevación de la FENO hasta niveles patológicos. Por este motivo, es recomendable investigarla antes de llevar a cabo el estudio de los valores de referencia de la FENO en población sana.
FinanciaciónProyecto financiado por el Departamento de Salud de Alzira (Becas 2008).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresan su agradecimiento a M. Muniesa Pellicer por su colaboración en el trabajo de campo.