El objetivo del estudio es evaluar la utilidad de la calprotectina fecal (CPF) en lactantes con sospecha de alergia a las proteínas de leche de vaca (APLV) no IgE mediada tanto para el diagnóstico como para predecir la respuesta clínica a la supresión láctea.
Pacientes y métodosEstudio prospectivo, de un año de duración, incluyendo 82 lactantes entre 1-12 meses en el Área Este de Málaga-Axarquía. De ellos: 40 se diagnostican de APLV no IgE mediada (síntomas compatibles y respuesta positiva a la supresión láctea), 12 no se confirma APLV y además 30 como grupo control. Se determina CPF al diagnóstico, al mes y a los 3 meses. El análisis estadístico realizado fue ANOVA para medidas repetidas, regresión logística nominal y curvas ROC utilizando los programas SPSS 20 y Medcalc.
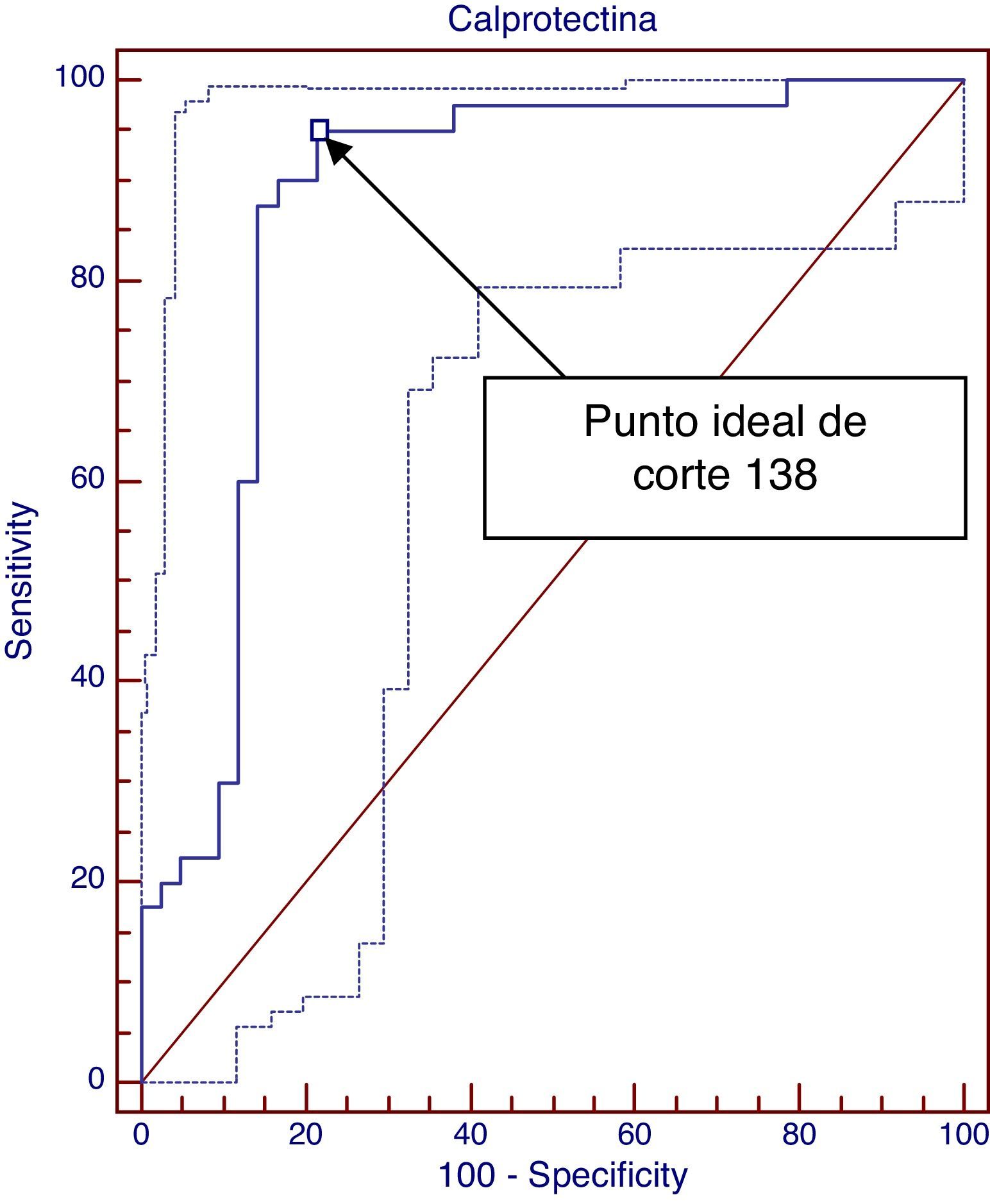
ResultadosSe analizan diferencias entre los grupos y se objetiva relación estadísticamente significativa entre cifras elevadas de CPF y padecer APLV (p <0,0001). También se constata relación estadísticamente significativa entre cifras de CPF al diagnóstico, al mes y a los 3 meses (p<0,001). Finalmente se realiza una curva ROC entre cifras de CPF y diagnóstico de APLV resultando una área bajo la curva de 0,89 y siendo 138μg/g el mejor nivel de corte. Sin embargo, para predecir respuesta clínica este valor es únicamente de 0,68.
ConclusionesCifras de CPF inferiores a 138μg/g podrían ser útiles para descartar el diagnóstico de APLV no IgE mediada. La CPF no es un buen test para predecir respuesta clínica a la exclusión láctea.
The aim of the study was to assess the use of faecal calprotectin (FCP) in infants with signs and symptoms of non-IgE-mediated cow's milk protein allergy (CMA) for both diagnosis and prediction of clinical response at the time of withdrawal of milk proteins.
Patients and methodsA one year prospective study was conducted on 82 infants between 1 and 12 months of age in the Eastern area of Málaga-Axarquía, of whom 40 of them had been diagnosed with non-IgE-mediated CMA (with suggestive symptoms and positive response to milk withdrawal), 12 not diagnosed with CMA, and 30 of them were the control group. FCP was measured at three different times: time of diagnosis, and one and three months later. ANOVA for repeated measures, nominal logistic regression and ROC curves were prepared using the SPSS.20 package and Medcalc.
ResultsDifferences between diagnostic and control groups were assessed: there was a statistically significant relationship (p<.0001) between high FCP levels and infants suffering CMA, as well as the levels at time of diagnosis, 1 and 3 months (p <.001). A ROC curve was constructed between FCP levels and diagnosis of CMA, with 138 ug/g, with the best cut-off being with an area under the curve of 0.89. However, it is only 0.68 to predict a clinical response.
ConclusionsFCP levels lower than 138ug/g could be useful to rule out non-IgE-mediated CMA diagnosis. Calprotectin is not a good test to predict clinical response to milk withdrawal
La alergia a las proteínas de leche de vaca (APLV) es un problema frecuente con una prevalencia estimada entre el 2 y el 7,5%1. Se clasifica en inmunoglobulina E (IgE) mediada y no IgE mediada. En el primer grupo suelen predominar los síntomas cutáneos y respiratorios, como urticaria, angioedema y anafilaxia tras la ingesta de leche de vaca. El diagnóstico se basa en la historia clínica detallada y se confirma mediante pruebas alérgicas tipo IgE específica y/o prick test y la provocación posterior. En el segundo grupo predominan síntomas digestivos, como diarrea, vómitos, sangre en las heces, irritabilidad o fallo de medro. Dado que este grupo no es IgE mediado no son útiles para el diagnóstico ni la IgE específica ni el prick test, por tanto, ante la sospecha clínica la única arma diagnóstica sería la retirada de las proteínas de leche de vaca de la dieta durante 4-6 semanas confirmando la resolución de los síntomas. La retirada de las proteínas lácteas conlleva el uso de hidrolizados extensos de proteínas que suponen tanto un coste económico importante como, en muchas ocasiones, un rechazo del lactante y su familia por el mal sabor y olor de estas fórmulas1–7.
La calprotectina fecal (CPF) es una proteína contenida principalmente en el citoplasma de los neutrófilos, aunque también se encuentra en la membrana de los monocitos y de los macrófagos activados. Por tanto, sus niveles se elevan ante la presencia de procesos infecciosos y/o inflamatorios. En los últimos años, la CPF se está afianzando como marcador no invasivo para el diagnóstico diferencial entre patología orgánica y funcional8–12.
Dado que en la APLV no IgE mediada el diagnóstico se basa en la sospecha clínica y la exclusión de las proteínas de leche de vaca de la dieta para valorar respuesta, nos planteamos como objetivo evaluar la utilidad de la CPF en lactantes con signos y síntomas sugestivos de APLV no IgE mediada tanto para el diagnóstico como para predecir la respuesta clínica a la exclusión láctea.
Pacientes y métodosEl estudio de carácter prospectivo se ha efectuado durante un año. Se han incluido 82 lactantes entre 1-12 meses de edad que acuden a consulta externa de Pediatría del Hospital de la Axarquía en el Área Este de Málaga.
Aspectos clínicosCriterios de inclusión: lactantes entre 1-12 meses de edad que presenten sintomatología compatible con APLV no IgE mediada como: diarrea, vómitos, sangre en heces, irritabilidad y/o fallo de medro1,2. Se incluyen 52 lactantes que presentando alguno de estos síntomas son derivados desde Atención Primaria para entrar en el estudio.
Criterios de exclusión: lactantes de<1 mes o>12 meses, APLV IgE mediada, para ello se realizó IgE total y específica y/o prick test. Además se excluyó a pacientes en los que se confirmara patología infecciosa mediante coprocultivo y urocultivo, pretérminos o aquellos que tuviesen patología crónica de base.
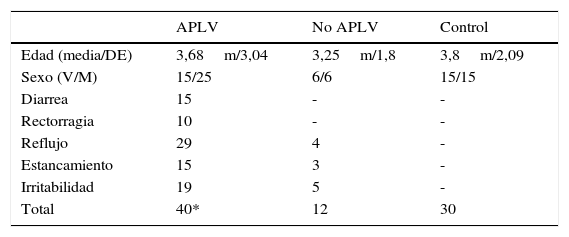
Cincuenta y dos pacientes cumplieron los criterios de inclusión por lo que se tomó muestra para CPF y se les retiró las proteínas lácteas por un hidrolizado proteico extenso durante un período de 4 semanas. Tras este período se evaluó la respuesta clínica mediante entrevista a la madre valorándola como nula, escasa o buena. Se consideró buena respuesta en 40 pacientes formando el grupo de estudio APLV no IgE mediada. Doce pacientes tuvieron escasa o nula respuesta, formando el grupo no diagnosticados de APLV no IgE mediada. De este segundo grupo 5 pacientes se diagnosticaron de cólico del lactante con evolución clínica favorable sin otro tratamiento, 4 diagnosticados de reflujo gastroesofágico, de los cuales solo uno precisó tratamiento con domperidona y antiácido y, por último, 3 fallo de medro en los que no se llegó a otro diagnóstico. Finalmente seleccionamos 30 lactantes como grupo control con edades comprendidas entre 1-12 meses. El grupo control se nutrió de la consulta de riesgo neurológico, estando libres de síntomas digestivos o de patología infecciosa y se les tomó una muestra aislada para CPF (tabla 1).
Características generales
| APLV | No APLV | Control | |
|---|---|---|---|
| Edad (media/DE) | 3,68m/3,04 | 3,25m/1,8 | 3,8m/2,09 |
| Sexo (V/M) | 15/25 | 6/6 | 15/15 |
| Diarrea | 15 | - | - |
| Rectorragia | 10 | - | - |
| Reflujo | 29 | 4 | - |
| Estancamiento | 15 | 3 | - |
| Irritabilidad | 19 | 5 | - |
| Total | 40* | 12 | 30 |
* Varios pacientes presentaban más de un síntoma al diagnóstico. DE: desviación standard.
Tanto en el grupo diagnosticado de APLV no IgE mediada como en el no diagnosticado de APLV no IgE mediada se realizó CPF al diagnóstico, al mes y a los 3 meses de la retirada de las proteínas lácteas. El seguimiento se completó hasta que se consiguió la reintroducción de leche de vaca.
Los padres o tutores de los sujetos participantes aceptaron formar parte del estudio mediante consentimiento informado. El estudio cumple las normas éticas de la Declaración de Helsinki y las aplicables a estudios observacionales en España.
Aspectos analíticos- Estudio de alergia: para descartar alergia IgE mediada se realizó IgE total mediante electroquimioluminiscencia (ECLIA) medido en UI/ml y con valores normales entre 0-100 e IgE específica a proteínas de leche de vaca mediante InmunoCAP (inmunoenzimoensayo enzimático fluorescente, FEIA) medido en KU/l y con valor normal<0,35. En los casos que la IgE específica fue positiva se realizó prick test con estracto purificado de leche entera de vaca concentrado 10mg/ml.
- Coprocultivo bacteriano y látex a rotavirus y adenovirus.- La determinación de CPF se realizó mediante determinación cuantitativa ELISA con el test Calprest® de Eurospital medida en μg/g cuyos valores de referencia son:<70μg/g negativo, 70-100μg/g área borderline y>100μg/g positivo. La sensibilidad diagnósitca del test es del 95%, la especificidad del 93% y el valor predictivo negativo (VPN) del 98%. Dado el alto VPN de la prueba los falsos negativos son raros pero sí son frecuentes los falsos positivos, cualquier enfermedad infecciosa, incluso del tracto respiratorio superior, puede elevar las cifras de CPF. Además, en la literatura, se encuentran referencias de cifras discretamente elevadas de CPF en lactantes menores de un mes y prematuros sin que se objetive patología alguna13–16.
Aspectos estadísticos: se emplearon t-test para comparación de variables cuantitativas, ANOVA para la comparación de los valores de CPF al diagnóstico y la presencia de APLV, y ANOVA para medidas repetidas para comparar los niveles de CPF en los 3 momentos de medida (diagnóstico, al mes y a los 3 meses) y la respuesta clínica, presencia de diarrea, rectorragia, reflujo, irritabilidad y estancamiento ponderal. Se realizó regresión logística nominal y curvas receiver operating characteristic (ROC) para valorar la utilidad de la CPF como diagnóstico y como medida predictora de la respuesta clínica. La significación estadística considerada en todos los test fue<0,05. Los programas estadísticos utilizados fueron SPSS 20 (SPSS, Inc. Chicago, Illinois, EE. UU.) y Medcalc 14.8.1 (MedCalc Software bvba).
ResultadosCon los 82 pacientes estudiados se forman 3 grupos: 40 diagnosticados de APLV no IgE mediada; 12 no diagnosticados de APLV no IgE mediada; 30 grupo control. La estadística descriptiva fue la siguiente: respecto al sexo, 46 niñas (56,1%) y 36 niños (43,9%). No se encontró relación estadísticamente significativa entre cifra de CPF y sexo (p 0,946). La media de edad fue 3,68, 3,25 y 3,8 meses en APLV, no APLV y controles respectivamente, sin diferencias significativas (p 0,606) entre las medias de edad en cada uno de los grupos estudiados.
Se estudiaron posibles diferencias entre las cifras medias de CPF al diagnóstico en cada uno de los grupos mediante ANOVA, encontrando diferencias estadísticamente significativas en las medias de CPF entre cada uno de los grupos analizados (p<0,0001). Así, la media de CPF en el grupo APLV no IgE mediada fue de 442,65μg/g, en el grupo de no APLV de 268,58μg/g y en el grupo control 100,30μg/g (tabla 2).
Además se compararon las medias de CPF según el momento de realización, tanto en el grupo APLV como en el no APLV, mediante ANOVA para medidas repetidas, y se observó que había diferencias estadísticamente significativas (p<0,001) entre las realizadas al diagnóstico (442,65μg/g), al mes (228,51μg/g) y a los 3 meses (92,78μg/g) de la retirada de las proteínas lácteas.
Según el síntoma de presentación clínica se encontró que existía relación estadísticamente significativa entre cifras medias elevadas de CPF y clínica de diarrea (p 0,005; media 587,4μg/g) y rectorragia (p <0,001; media 655,4μg/g). No se encontró relación significativa si el síntoma analizado fue reflujo (p 0,438; media 346,24μg/g), estancamiento ponderal (p 0,451; media 371,57μg/g) o irritabilidad (p 0,469; media 392μg/g).
Con la intención de documentar la relación entre cifra elevada de CPF al diagnóstico y APLV no IgE mediada realizamos una regresión logística nominal y construimos una curva ROC mediante el programa Medcalc como muestra la figura 1. Analizamos las cifras de CPF al diagnóstico comparando las del grupo APLV frente a las obtenidas en los grupos no APLV y controles. El área bajo la curva obtenida es 0,889, lo que sugiere un buen test diagnóstico (se considera un buen test entre 0,75-0,9 y excelente>0,9). Este programa tiene la ventaja que sugiere el nivel de corte que maximiza la mejor sensibilidad para la mejor especificidad, que en esta ocasión es 138μg/g. Valores superiores a 138μg/g logran una sensibilidad del 95%, especificidad 78,57%, valor predictivo positivo 80,9 y VPN 94,3, cociente de probabilidad positivo 4,43 y cociente de probabilidad negativo 0,06. Utilizando los cocientes de probabilidad positivos y negativos y con base en la prevalencia (probabilidad pretest de APLV 2%) podemos calcular la probabilidad postest mediante el nomograma de Fagan. En nuestro caso, cifras de CPF superiores a 138μg/g aumentan la probabilidad de padecer APLV no IgE mediada al 8,1%, mientras que valores inferiores a 138μg/g la descartan.
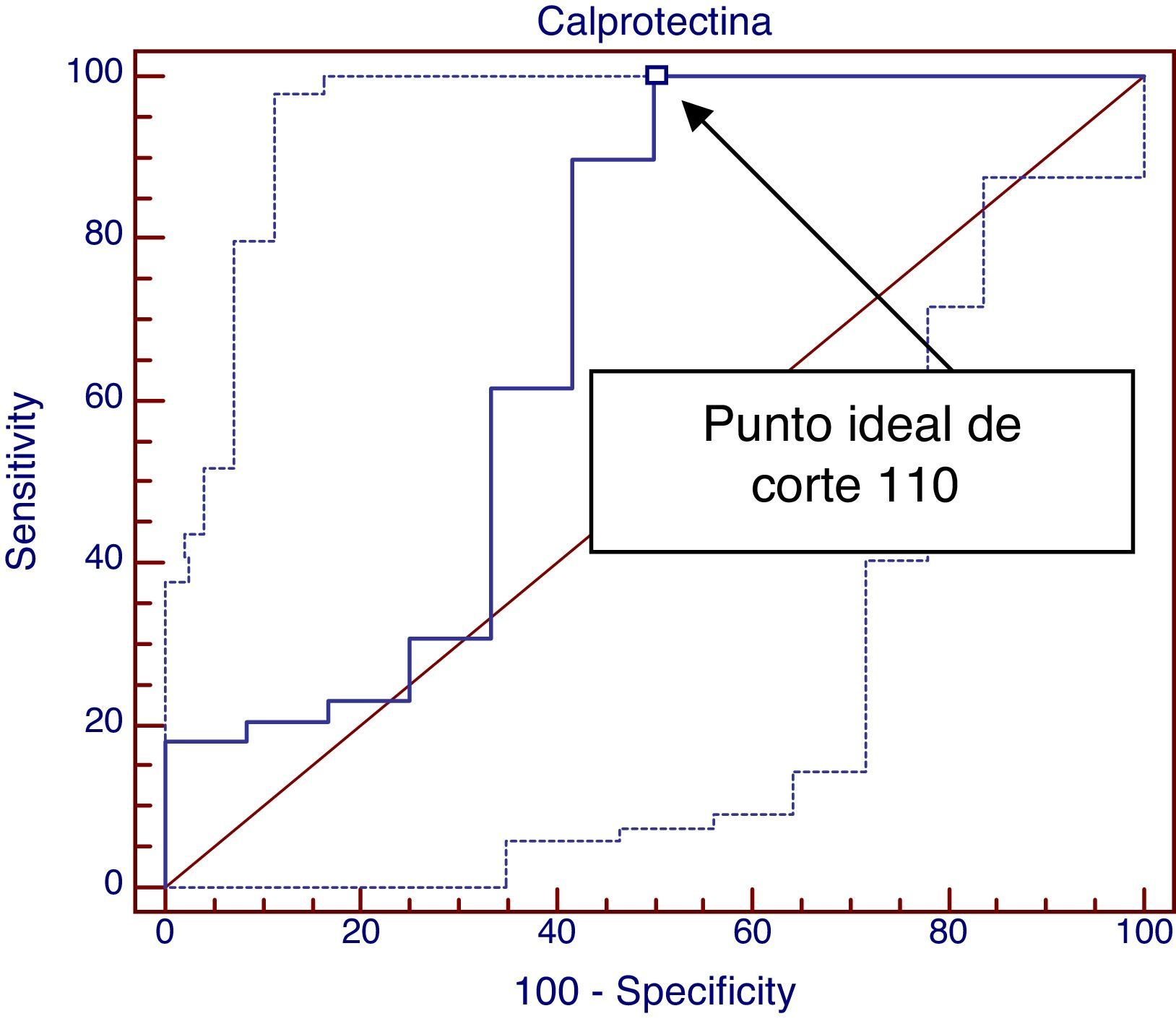
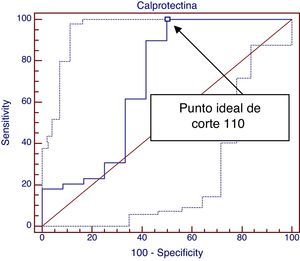
Por último, construimos otra curva ROC con la intención de relacionar cifras elevadas de CPF al diagnóstico con una respuesta clínica positiva al mes de la retirada de proteínas lácteas como vemos en la figura 2. El área bajo la curva obtenida es de 0,688 (buen test entre 0,75-0,9), mientras que el mejor nivel de corte es de 110 que consigue una sensibilidad del 100% pero con una especificidad tan solo del 50%.
DiscusiónEl diagnóstico de la APLV no IgE mediada es puramente clínico y su confirmación se basa en la retirada de proteínas vacunas y la constatación de una mejoría clínica tras 4-6 semanas de dieta de exclusión junto con la reaparición de los síntomas tras una nueva exposición a dichas proteínas1–5. El objetivo de este estudio ha sido valorar la utilidad de una prueba sencilla, que pueda apoyar o ir en contra de la decisión de utilizar una fórmula exenta de proteínas de leche de vaca ante la sospecha clínica de APLV no IgE mediada. Esta decisión acarrea un coste económico no despreciable además de que, en casos en que la sospecha clínica sea por ejemplo estancamiento ponderal, la toma de este tipo de fórmulas va a tener cierta dificultad, dadas las características organolépticas de este tipo de fórmulas4.
La CPF ha demostrado ser una herramienta rápida, fiable y reproducible, que permite diferenciar pacientes con patología gastrointestinal orgánica de otros con patología gastrointestinal funcional. La mayoría de la bibliografía sobre CPF versa sobre la enfermedad inflamatoria intestinal con un magnífico rendimiento, aunque también hay estudios realizados en otras patologías gastrointestinales en las que parece que puede ser de utilidad como: gastroenteritis aguda y rechazo de transplante intestinal, y otras como: la celiaquía y el dolor abdominal recurrente en las que no parece que sea demasiado relevante17–22. Recientemente se ha publicado un estudio en el que se miden niveles de CPF en niños con APLV no IgE mediada, encontrando cifras de CPF más elevadas en el grupo que responde a la dieta libre de proteínas lácteas respecto al que no responde23.
Por tanto, pensamos que la CPF puede ser una herramienta útil para apoyar el diagnóstico en una patología gastrointestinal orgánica cuyo diagnóstico es puramente clínico como la APLV no IgE mediada.
Los resultados obtenidos en nuestro estudio corroboran la hipótesis inicial, dado que la comparación de medias de CPF en los distintos grupos observados demuestra diferencias estadísticamente significativas, siendo las medias de CPF muy superiores en el grupo APLV no IgE mediada (442,65μg/g) respecto al no diagnosticado de APLV (268,58μg/g) y al grupo control (100,30μg/g).
Sin embargo, cuando estudiamos por separado según síntoma de presentación solo encontramos diferencias significativas si se presentan como diarrea y/o rectorragia, lo que podría explicarse por mayor presencia de inflamación en el aparato digestivo. En el caso de reflujo, irritabilidad y estancamiento ponderal, encontramos medias relativamente altas pero sin diferencias significativas y sería en estos casos en los que más necesitaríamos ayuda para el diagnóstico, dado que si el lactante presenta diarrea y/o rectorragia es más fácil tomar la decisión de utilizar fórmulas hidrolizadas que en el caso de presentarse simplemente como irritabilidad o estancamiento ponderal. Debemos tener en cuenta que la mayoría de los pacientes presentaba más de un síntoma al diagnóstico. Este puede ser el motivo de encontrar medias de CPF superiores a 300μg/g en aquellos casos con reflujo, irritabilidad o estancamiento ponderal, en concreto coinciden 3 casos que presentan rectorragia, irritabilidad y estancamiento ponderal con cifras muy altas de CPF (1.353μg/g/878μg/g/862μg/g) que elevan sensiblemente la media.
También encontramos diferencias estadísticamente significativas entre las cifras de CPF realizadas al diagnóstico respecto a las realizadas al mes y a los 3 meses, es decir, tras la retirada de las proteínas vacunas se produce un descenso significativo de las cifras de CPF (441μg/g/228μg/g/92μg/g). Este descenso se produjo en paralelo a la mejoría de los síntomas en respuesta a la exclusión láctea en el grupo APLV, sin embargo, en el grupo no APLV la evolución fue más dispar: en 6 casos las cifras de CPF se mantuvieron con pocas diferencias y siempre con valores menores de 100μg/g, en 3 casos hubo un descenso significativo y en otros 3 se constató elevación de las cifras de CPF, 2 pacientes con reflujo y uno con cólico del lactante. En estos 3 casos hubo buena evolución clínica pero la CPF se normalizó posteriormente.
El análisis de las curvas ROC nos ofrecen unos resultados interesantes. En primer lugar construimos una curva ROC con las cifras de CPF al diagnóstico en el grupo APLV no IgE mediada demostrando ser un buen test diagnóstico (área bajo la curva de 0,889 con IC 95%: 0,809-0,968). Calculamos el mejor nivel de corte que maximiza la mejor sensibilidad para la mejor especificidad, que en esta ocasión es 138μg/g, es decir, cifras de CPF superiores a 138μg/g ofrecen una sensibilidad del 95% y una especificidad del 78% con valor predictivo positivo 80,9% y VPN de 94%. A medida que utilicemos un punto de corte más alto aumentará la especificidad y disminuirá la sensibilidad. Además, utilizando los cocientes de probabilidad positivo (4,43) y negativo (0,06), mediante el nomograma de Fagan y teniendo en cuenta la prevalencia de la APLV en torno al 2%4,5, calculamos la probabilidad postest de tener APLV. En nuestro caso, cifras superiores a 138μg/g elevarían la probabilidad de tener APLV del 2-8,1% y lo que parece más importante, si la cifra es menor se descarta (probabilidad postest de la prueba negativa 0,13%).
Con los resultados obtenidos en la segunda curva ROC, niveles menores de 110μg/g de CPF aseguran que exista una respuesta (sensibilidad del 100%) pero valores por encima del mismo no aseguran una respuesta negativa (especificidad 50%), por lo tanto no podemos considerar la CPF como un buen test para predecir respuesta positiva a la retirada de proteínas vacunas (área bajo la curva ROC 0,68, IC 95%: 0,48-0,89).
Además, nos llamó la atención que en el grupo control, libre de patología digestiva, la media de CPF fue de 109, es decir, encontramos cifras ligeramente elevadas en lactantes por otro lado sanos. Estos resultados coinciden con otros estudios consultados, sobre todo cuando las determinaciones se realizan en niños pequeños, menores de un mes y/o pretérminos13–16. Por último, debemos hacer una autocrítica. Para formar el grupo APLV no IgE mediada solo tuvimos en cuenta la respuesta clínica a las 4 semanas de la retirada de las proteínas lácteas sin hacer una reintroducción de leche para confirmar la reproducción de los síntomas2. De este modo, es posible, que el diagnóstico esté sobredimensionado, sobre todo en aquellos pacientes que debutaban con síntomas poco específicos como estancamiento e irritabilidad. Además, es sabido que, en ocasiones este tipo de patología es transitoria y cede en poco tiempo. De todas formas, en la práctica clínica diaria no es fácil realizar la reintroducción de lácteos, sobre todo en aquellos lactantes que han tenido una evidente mejoría.
Por tanto, concluimos que: 1. cifras de CPF inferiores a 138μg/g podrían ser útiles para descartar el diagnóstico de APLV no IgE mediada; 2. la CPF no sirve como ayuda en el diagnóstico de APLV no IgE mediada en niños con síntomas de reflujo, estancamiento ponderal e irritabilidad, aunque va a estar muy elevada en aquellos que presenten síntomas como diarrea y rectorragia; 3. la CPF no es un buen test para predecir respuesta clínica en lactantes con sospecha de APLV no IgE mediada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado en el XXI Congreso Nacional de Gastroenterología Herpatología y Nutrición Pediátrica en Pamplona el 24 de mayo de 2014.