Presentamos una revisión de la evidencia sobre epidemiología, factores de riesgo, etiología y perfil clínico-etiológico de la bronquiolitis aguda. Las estimaciones de frecuencia son muy heterogéneas; para población menor de 2 años la frecuencia de ingreso por bronquiolitis se sitúa entre 1 y 3,5%, la de consultas en Atención Primaria entre 4 y 20% y la de Urgencias entre 1 y 2%. Para población de riesgo la frecuencia de ingresos por infección respiratoria por virus respiratorio sincitial es en prematuros de ≤32 semanas de gestación entre 4,4 y 18%, en niños con displasia broncopulmonar entre 7,3 y 42%, y en cardiópatas entre 1,6 y 9,8%. Los principales factores de riesgo son: prematuridad, enfermedad pulmonar o displasia broncopulmonar, las cardiopatías congénitas y la edad al inicio de la epidemia inferior a 3–6 meses. Otros factores son: hermanos mayores o asistencia a guardería, sexo masculino, exposición a tabaco, lactancia materna durante menos de 1–2 meses y variables asociadas a bajo nivel socioeconómico. El virus respiratorio sincitial es el agente etiológico dominante, constituyendo algo más de la mitad de los casos (mediana 56%; intervalo 27–73%). Otros virus implicados por orden descendente de frecuencia son los rinovirus, adenovirus, metapneumovirus, virus de la gripe, parainfluenza, enterovirus y bocavirus. En estudios que recurren a técnicas de detección genómica, el virus implicado no es identificado en un 20–25% de los casos; entre el 9% y el 27% de los casos presentan coinfección viral. Aunque las bronquiolitis por virus respiratorio sincitial tienen más sibilantes y trabajo respiratorio, mayor duración de síntomas y oxigenoterapia y se asocian a menor uso de antibióticos, estos datos están asociados a la menor edad de los pacientes y no permiten predecir la etiología. En general, la identificación etiológica no resulta útil de cara al manejo de los pacientes; no obstante, en lactantes pequeños (<3 meses) con bronquiolitis febriles en el medio hospitalario, podría facilitar el manejo conservador de dichos pacientes y ahorrar procedimientos diagnóstico y terapéuticos.
A review of the evidence on epidemiology, risk factors, etiology and clinical-etiological profile of acute bronchiolitis is presented. The frequency estimates are very heterogeneous; in the population under two years the frequency of admission for bronchiolitis is between 1 and 3.5%, primary care consultations between 4 and 20% and emergency visits between 1 and 2%. The frequency of admissions for respiratory infection by respiratory syncytial virus in the risk population is: in premature infants ≤32 weeks of gestation between 4.4 and 18%, in patients with bronchopulmonary dysplasia between 7.3 and 42%, and in infants with congenital heart disease between 1.6 and 9.8%. The main risk factors are: prematurity, chronic lung disease or bronchopulmonary dysplasia, congenital heart disease and age less than 3–6 months at onset of the epidemic. Other factors are: older siblings or day care attendance, male gender, exposure to smoking, breastfeeding for less than 1–2 months and variables associated with lower socioeconomic status. Respiratory syncytial virus is the dominant etiological agent, constituting just over half the cases (median 56%; interval 27% to 73%). Other viruses implicated, in descending order of frequency, are rhinovirus, adenovirus, metapneumovirus, influenza viruses, parainfluenza, enterovirus and bocavirus. In studies with genomic detection techniques, between 20 and 25% of cases the virus involved is not identified and between 9% and 27% of cases have viral co-infection. Although respiratory syncytial virus bronchiolitis shows more wheezing and retractions, longer duration of respiratory symptoms and oxygen therapy and are associated with lower use of antibiotics. This pattern is associated with the younger age of the patients and does not help us to predict the etiology. In general, the etiological identification is not useful for the management of patients. However, in young infants (<3 months) with febrile bronchiolitis in the hospital environment, conservative management may help these patients and avoid diagnostic and therapeutic procedures.
Presentamos una revisión de la evidencia sobre epidemiología, factores de riesgo, etiología y perfil clinicoetiológico de la bronquiolitis aguda (BA). Esta revisión forma parte de la documentación elaborada para la «Conferencia de Consenso sobre BA», en la que se sustenta el estudio de idoneidad del proyecto titulado «Variabilidad e idoneidad del manejo diagnóstico y terapéutico de la BA» (estudio BRonquiolitis-Estudio de Variabilidad, Idoneidad y ADecuación [aBREVIADo]). La metodología de la revisión ha sido publicada en un artículo previo de esta serie1.
IntroducciónLa BA es la principal causa de ingreso por infección respiratoria aguda (IRA) de vías bajas en el niño menor de 2 años. El virus respiratorio sincitial (VRS) es el agente causal dominante, aunque otros virus están también implicados, tanto de forma aislada como en coinfección: rinovirus, adenovirus, metapneumovirus (MVP), virus influenza y parainfluenza, enterovirus y bocavirus. En nuestro medio, la mayoría de las infecciones por VRS tienen lugar en las épocas epidémicas (final de otoño e invierno), quedando expuestos a este virus la mayoría de los lactantes en al menos una ocasión. Por otra parte, la infección no genera una respuesta inmunitaria que proteja frente a nuevas reinfecciones.
El diagnóstico de la BA es clínico, se presenta habitualmente con rinitis, dificultad respiratoria, tos, rechazo de alimentación, irritabilidad y, en lactantes muy pequeños, apneas. Estos hallazgos clínicos, junto con la existencia de sibilantes y/o crepitantes en la auscultación, permiten realizar el diagnóstico. No obstante, existe una importante heterogeneidad entre países a la hora de diagnosticar la BA. Mientras que en Norteamérica se propugna la presencia de sibilantes espiratorios como principal signo guía, en el Reino Unido dicho papel es atribuido a los crepitantes.
Los criterios clásicos más aceptados son los propuestos por McConnochie2, que considera BA «el primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con/sin fiebre), que afecta a niños menores de 2 años, aunque preferentemente se da en el primer año de vida».
Un importante número de condiciones puede simular BA. Entre las causas pulmonares destacan el asma, la neumonía, la enfermedad pulmonar crónica, la inhalación de un cuerpo extraño y la fibrosis quística. Otras entidades no pulmonares incluyen la cardiopatía congénita, la sepsis y la acidosis metabólica grave.
Lamentablemente, la información sobre validez y precisión de los distintos signos o síntomas de BA procede exclusivamente de estudios descriptivos y sobre todo de la opinión de expertos3. Por ello, no sorprende que el espectro clínico de los pacientes catalogados como BA en los distintos trabajos pueda ser tan heterogéneo. El principal problema radica en la diferenciación de los pacientes con sibilantes recurrentes, como manifestación de una predisposición atópica en respuesta a desencadenantes infecciosos o ambientales diversos. Tanto la evolución como la respuesta a tratamientos van a ser en estos pacientes diferentes. En este sentido, 2 criterios pueden resultar útiles a la hora de restringir los sesgos de selección en los estudios epidemiológicos: limitar los casos a primeros episodios de sibilantes en niños menores de 2 años. Por el contrario, la identificación de VRS en las muestras respiratorias, aunque más frecuente en los casos de BA, no permite diferenciarlos de otros diagnósticos alternativos.
El diagnóstico microbiológico en la BA apenas influye en el manejo del paciente. Los signos y síntomas de BA no permiten diferenciar los casos producidos por el VRS del resto y, aunque existen ciertos perfiles clínicos asociados a los distintos agentes etiológicos implicados, no está clara la capacidad predictiva ni la utilidad práctica de la identificación de dichos perfiles etiológicos.
La carga clínica de la BA es importante por su frecuencia y repercusión. No obstante, la mayoría de los casos son autolimitados, persistiendo los síntomas entre 3 y 7 días, pudiendo ser manejados en su domicilio con medidas sintomáticas. Solo un pequeño porcentaje de pacientes requiere ingreso hospitalario, que suele estar motivado por la necesidad de recibir cuidados como la administración de oxígeno suplementario, la aspiración de secreciones o la alimentación enteral o parenteral. Por ello, evaluar la frecuencia y el riesgo de las BA a través del estudio de los casos hospitalizados es una estrategia incompleta y probablemente sesgada, ya que el criterio de ingreso hospitalario presenta una gran variabilidad entre áreas y sistemas sanitarios. Sin embargo, la mayor parte de la evidencia disponible procede de pacientes hospitalizados.
Los niños de menor edad y los que tienen problemas médicos previos (prematuridad, cardiopatía congénita, enfermedad pulmonar crónica o displasia broncopulmonar, etc.) son más susceptibles de tener enfermedad grave y requerir ingreso hospitalario. La identificación de factores de riesgo o marcadores clínicos de gravedad puede resultar útil en la toma de decisiones médicas. En los últimos años ha surgido un especial interés por identificar factores de riesgo de BA, en relación con la disponibilidad de intervenciones preventivas de alto coste (anticuerpos monoclonales frente al VRS), para las que se propone un uso restringido.
Frecuencia de la bronquiolitis agudas y factores de riesgoLa información sobre la frecuencia de la BA debe idealmente proceder de estudios de cohortes en los que se sigan, con procedimientos correctos, recién nacidos con o sin factores de riesgo, para detectar la aparición de BA, diagnosticadas en el medio ambulatorio u hospitalario con criterios clínicos válidos.
Asimismo, interesa identificar factores de riesgo de presentar BA que tengan suficiente capacidad predictiva para ser tenidos en cuenta en la toma de decisiones médicas. Esta información procederá fundamentalmente de estudios de cohortes y de estudios de casos y controles. En estos trabajos, además de los requisitos previamente expuestos para los estudios de frecuencia, interesa especialmente emplear métodos de ajuste multivariante que permitan diferenciar el efecto independiente atribuible a cada factor de riesgo.
Volumen de la evidenciaSe han revisado 32 estudios que evalúan el riesgo de BA4–16, IRA de vías bajas por VRS17–19, infección por VRS6,16,20–34 o enfermedad respiratoria21,34,35, en la mayoría de ellos, ingresos hospitalarios por dichos procesos. En la tabla 1 se presentan las características y los resultados simplificados de estos estudios (información extraída de las tablas de evidencia originales de la revisión). En 20 de esos estudios se ha estimado el riesgo en población de riesgo: prematuros5–7,11,17,18,21–23,25,28–32,35, cardiópatas5,6,20,22,27, pacientes con enfermedad pulmonar crónica5,6,20,22,29 o con síndrome de Down11,19. Los diseños más frecuentes han sido: cohortes retrospectivos5–7,9,11–14,19,22,23,25,26,29–33 o prospectivos8,17,18,20,21,24,27,28,35, estudios ecológicos4,10,16 y transversales15. La calidad es medio-baja, predominando los trabajos que utilizan los códigos diagnósticos del alta hospitalaria como método de detección de casos. En algunas ocasiones se han empleado registros de pruebas microbiológicas y, solo excepcionalmente, criterios clínicos propios o de referencia de BA2. En muchos trabajos no se controla si los casos eran primeros episodios. Existe cierta variación en la edad de la muestra de estudio (habitualmente menores de 1 o 2 años, excepcionalmente de 3 o 5 años) y en el tiempo de seguimiento (estación epidémica, 1 o 2 años). Seis trabajos analizan el riesgo de ingreso por BA5,7,13 o infección por VRS21,26,34 en España.
Tabla simplificada de los trabajos sobre riesgo de bronquiolitis aguda
| Tipo de población/autor/año/país | n | E | D | Medida de riesgo | Riesgo | IC95% o intervalo | Calidad/comentarios |
| Riesgo de bronquiolitis | |||||||
| Cunningham35 (1991 EE.UU.) | H | CP | 2/5 (a,d); no hay información sobre la clínica o diagnóstico de los ingresos | ||||
| Prematuros ≤32 SG (alta de UCIN) | 156 | Ingreso <2 años enfermedad respiratoria | 36% | ||||
| Nacidos sanos | 121 | Ingreso <2 años enfermedad respiratoria | 2,5% | RR de ≤32 SG 14,58 (4,66 a 45,62) | |||
| Wang20 (1997 Canadá) | 427 | H | CP | 3/5 (a,c,d); seguimiento ambulatorio en un hospital de niños con cardiopatía o EPC entre 1993 y 1995 | |||
| Enfermedad pulmonar crónica <3 años | IRA baja por VRS | 11% | |||||
| Ingreso por infección por VRS | 6% | ||||||
| Cardiopatía compleja <3 años | IRA baja por VRS | 12% | Asociación entre títulos altos de anticuerpos frente a VRS y menor riesgo de IRA baja por VRS pero no de ingreso, ingreso por VRS o por IRA baja VRS- | ||||
| Ingreso por infección por VRS | 3% | ||||||
| Shay4 (1999 EE.UU.) | P | Ec | 3/5 (a,b,d); Datos de base de datos de ingresos de una muestra de hospitales | ||||
| Población <1 año 1980 | Tasa de ingreso por BA (CIE) anual | 1,29% | |||||
| Población <1 año 1996 | Tasa de ingreso por BA (CIE) anual | 3,12% | Aumento de BA respecto a IRA bajas (22,2% a 47,4%) e ingresos totales (5,4% a 16,4%) | ||||
| Bonillo-Perales5 (2000 España) | P | CR | 2/5 (a,c); Almería | ||||
| Nacidos 1997–2000 | 12.895 | Ingreso <2 años por BA | 3,52% | ||||
| Prematuros | 1.303 | Ingreso <2 años por BA | 8,6% | ||||
| <32 SG | 160 | Ingreso <2 años por BA | 10,6% | ||||
| 32–35 SG | 491 | Ingreso <2 años por BA | 7,9% | ||||
| Displasia broncopulmonar | 19 | Ingreso <2 años por BA | 42,1% | ||||
| Cardiopatía con hiperaflujo | 102 | Ingreso <2 años por BA | 9,8% | ||||
| Boyce6 (2000 EE.UU.) | 248.952 | P | CR | 3/5 (a,c,e); recién nacidos 1989–1993 (Medicaid) | |||
| Nacidos sin riesgo | Ingreso <1 año por BA o IRA VRS+ | 3% | Revisión de códigos diagnósticos | ||||
| Displasia broncopulmonar | Ingreso <1 año por BA o IRA VRS+ | 38,8% | El 95% de los ingresos diagnóstico de BA | ||||
| Cardiópatas | Ingreso <1 año por BA o IRA VRS+ | 9,2% | |||||
| Prematuros <28 SG | Ingreso <1 año por BA o IRA VRS+ | 7% | |||||
| Prematuros 29–33 SG | Ingreso <1 año por BA o IRA VRS+ | 6,6% | |||||
| Prematuros 33–36 SG | Ingreso <1 año por BA o IRA VRS+ | 5,7% | |||||
| Nacidos sin riesgo | Ingreso 2.° año por BA o IRA VRS+ | 0,37% | |||||
| Displasia broncopulmonar | Ingreso 2.° año por BA o IRA VRS+ | 7,3% | |||||
| Cardiópatas | Ingreso 2.° año por BA o IRA VRS+ | 1,8% | |||||
| Prematuros <28 SG | Ingreso 2.° año por BA o IRA VRS+ | 3% | |||||
| Prematuros 29–33 SG | Ingreso 2.° año por BA o IRA VRS+ | 0,8% | |||||
| Prematuros 33–36 SG | Ingreso 2.° año por BA o IRA VRS+ | 1% | |||||
| Carbonell-Estrany21 (2000 España) | 680 | H | CP | Ingreso por problema respiratorio | 20,2% | 3/5 (a,c,d); 25% etiología no determinada; | |
| Prematuros ≤32 SG (1998–1999) | Ingreso por infección VRS | 9% | Riesgo si se asume % VRS en el resto 13,4% | ||||
| González García7 (2000 España)Nacidos 1991–1995 | 3.400 | H | CR | Ingreso por BA (McConnochie) | 1,79% | 1,37 a 2,30% | 3/5 (a, c, e); |
| Carbonell-Estrany34 2001 España | 1.206 | H | CP | Ingreso por problema respiratorio | 20,7% | 3/5 (a,c,d); 10% etiología no determinada; | |
| Prematuros ≤32 SG (1999–2000) | Ingreso por infección VRS | 11,8% | Riesgo si se asume % VRS en el resto 13,1% | ||||
| Eriksson22 (2002 Suiza) | P | CR | 3/5 (a,c,d); años 1987–1998 | ||||
| Nacidos sin factores de riesgo | 46.231 | Ingresos por infección por VRS | 0,8 a 1,4% | Alternancia anual de epidemias de comienzo precoz e intensas con comienzo tardío y leves | |||
| Cardiópatas | 390 | Ingresos por infección por VRS | 1,6 a 3,2% | ||||
| Prematuros 33–35 SG | 1.461 | Ingresos por infección por VRS | 0,7 a 2,7% | Riesgo de epidemias leves vs. intensas | |||
| Prematuros <32 SG | 633 | Ingresos por infección por VRS | 2,9 a 7% | ||||
| Enfermedad pulmonar crónica | 244 | Ingresos por infección por VRS | 2,8 a 6,4% | ||||
| McCormick23 (2002 Irlanda del Norte) | H | CR | 3/5 (a,c,d); casos identificados de base de datos de microbiologia | ||||
| Altas de UCIN 1994–1999 | 2.507 | Ingreso por infección VRS | 5,4% | ||||
| Altas ≤35 SG de UCIN | 1249 | Ingreso por infección VRS | 6,4% | ||||
| Altas ≤32 SG de UCIN | 762 | Ingreso por infección VRS | 7,3% | ||||
| Albernaz8 (2003 Brasil) Nacidos 1993 | 5.304 | P | CP | Ingreso <1año por BA (CIE) | 2,1% | 3/5 (a,b,e); | |
| Liese24 (2003 Alemania) | 1.103 | H | CP | Ingreso por IRA (epidemia) | 10,6% | 4/5 (a,b,d,e); excluídos tratados con palivizumab | |
| Nacidos ≤35 SG 1998–1999 | Ingreso por IRA por VRS (probable) | 5,2% | |||||
| Nielsen9 (2003 Dinamarca) | 24.924 | H | CR | Ingreso <2 años por BA por VRS | 1,9% | 3/5 (a,b,c); revisión de registros hospitalarios | |
| Población <2 años 1990–1994 | |||||||
| MMWR10 (2003 EE.UU.) | P | Ec | 2/5 (a,b); registro poblacional | ||||
| Indios o nativos de Alaska | Consultas <5 años por BA (CIE) | 10,8% | 10,7 a 11% | ||||
| Ingresos <5 años por BA (CIE) | 1,5% | 1,5 a 1,8% | |||||
| Americanos | Consultas <5 años por BA (CIE) | 4,2% | 2,4 a 5,9% | ||||
| Ingresos <5 años por BA (CIE) | 1% | 0,7 a 1,2% | |||||
| Pedersen25 (2003 Dinamarca) | 240 | H | CR | Ingreso <2 años por infección VRS | 18% | 13 a 23% | 1/5 (c) |
| Nacidos <28 SG o <1.000g 1994–1995 | |||||||
| Vicente26 (2003 España) | 15.700 | H | CR | Ingreso <5 años por IRA por VRS | 0,62% | 1/5 (b); revisión de ingresos; Población de referencia <5 años (15.700) | |
| Población <5 años | Ingreso <2 años por IRA por VRS | 1,47% | |||||
| Duppenthaler27 (2004 Suiza) | P | CP | 3/5 (a,c,d); registro población nacidos 1997–2003; | ||||
| Cardiopatía congénita hem.significativa | 396 | Ingreso <1 año por IRA por VRS | 2% | 0,9 a 3,8 | |||
| Ingreso 1–2 años por IRA por VRS | 0,5% | 0,1 a 1,8 | |||||
| Sin cardiopatía hem. significativa | 54.529 | Ingreso <1 año por IRA por VRS | 1,2% | 1,1 a 1,3 | |||
| Ingreso 1–2 años por IRA por VRS | 0,2% | 0,16 a 0,23 | |||||
| Fjaerli11 (2004 Noruega) | H | CR | 4/5 (a,b,c,e); | ||||
| Nacidos entre 1993–2000 | 58.179 | Ingreso <2 años por BA por VRS | 1,4% | ||||
| Prematuros | 3.954 | Ingreso <2 años por BA por VRS | 1,6% | ||||
| S. Down | 52 | Ingreso <2 años por BA por VRS | 15% | ||||
| Lacaze-Masmonteil (2004 Francia) | 2.370 | H | CP | Ingreso por IRA baja (epidemia) | 15% | 3/5 (a,c,d); excluidos casos con palivizumab | |
| Nacidos <33 SG en 2000 | Ingreso por infección VRS (epidemia) | 7,2% | |||||
| Law17 (2004 Canadá) | 1.860 | H | CP | Ingreso por IRA baja (epidemia) | 7,6% | 4/5 (a,c,d,e); excluídos tratados con palivizumab | |
| Nacidos 33–35 SG 2001–2003 | Ingreso por IRA baja VRS+ (epidemia) | 3,6% | |||||
| Broughton18 (2005 Reino Unido) | 126 | H | CP | IRA baja VRS+ (ingresan 41%) | 34,9% | 2/5 (a,c); síntomas de IRA baja (tos, sibilantes, taquipnea); no diferencias en % ingreso de casos VRS+ y VRS- | |
| Prematuros <32 SG | IRA baja VRS- (ingresan 28%) | 39,6% | |||||
| Heikkinen29 (2005 Finlandia) | H | CR | 3/5 (a,c,d) | ||||
| Nacidos 1991–2000 | 35.811 | Ingreso <2 años con infección por VRS | 2,1% | ||||
| Enfermedad pulmonar crónica | 25 | Ingreso <2 años con infección por VRS | 12% | ||||
| Prematuros <28 SG | 168 | Ingreso <2 años con infección por VRS | 7,1% | ||||
| Prematuros 29–32 SG | 498 | Ingreso <2 años con infección por VRS | 6,8% | ||||
| Prematuros 33–35 SG | 1.133 | Ingreso <2 años con infección por VRS | 3,7% | ||||
| Nacidos >36 SG | 33.983 | Ingreso <2 años con infección por VRS | 1,9% | ||||
| Mansbach12 (2005 EE.UU.) | 1,8 mill. | A | CR | Incidencia anual Urgencias por BA (CIE) | 2,6% | 2,2 a 3,1% | 1/5 (e); incidencia anual; muestra aleatoria de visitas a Urgencias, selección de BA |
| Población <2 años 1992–2000 | |||||||
| Cilla30 (2006 España) | H | CR | 1/5 (a); | ||||
| Nacidos 1996–2000 (total) | 13.986 | Ingresos<2años por infección VRS | 2,5% | ||||
| Prematuros <33 SG | 113 | Ingresos<2años por infección VRS | 4,4% | ||||
| Prematuros 33–35 SG | 333 | Ingresos<2años por infección VRS | 7,8% | ||||
| Prematuros 36–37 SG | 1.362 | Ingresos<2años por infección VRS | 2,9% | ||||
| Díez-Domingo13 (2006 España)Población <2 años (2001–2002) | 83.205 | P | CR | Incidencia anual ingreso <2 años por BA | 1,12% | 2/5 (a,c) | |
| Incidencia anual ingreso <1 años por BA | 4% | ||||||
| Doering31 (2006 Alemania-Austria) | 1.158 | H | CR | Ingreso por IRA | 9,5% | 2/5 (a, c); casos de VRS comprobados o probables (diagnóstico de BA, apnea o sibilantes) | |
| Prematuros 29–35 SG | Ingreso por infección VRS probable | 4,9% | |||||
| Rietveld32 (2006 Holanda) | 140.661 | P | CR | 4/5 (a,c,d,e) | |||
| Nacidos <1 año (<2 si DBP) 1996–1998 | Ingreso <2 años por infección VRS | 1,7% | |||||
| Prematuros ≤32 SG | Ingreso <2 años por infección VRS | 8% | |||||
| Prematuros ≤32 SG con DBP | Ingreso <2 años por infección VRS | 10,4% | |||||
| Prematuros ≤32 SG sin DBP | Ingreso <2 años por infección VRS | 7,5% | |||||
| Sangare33 (2006 EE.UU.) | P | CR | Ingreso <1 año por infección VRS (CIE) | 1,71% | 1,69 a 1,72% | 2/5 (a,c) | |
| Nacidos en 1999–003 | |||||||
| Bloemers19 (2007 Holanda) S. Down | 206+241 | A | CR+CP | Ingreso <2 años por IRA baja VRS+ | 9,9% | 2/5 (a,c); | |
| Carrol14 (2007 EE.UU.) | 101.245 | P | CR | Consultas <1 año por BA (CIE) | 20% | 2/5: (c,e); recién nacidos (Medicaid) sin factores de riesgo (sin palivizumab) | |
| Recién nacidos sin riesgo | Ingreso >3 días <1año por BA (CIE) | 2,26% | |||||
| Mansbach15 (2007 EE.UU.) | 8,7 mill. | A | T | Incidencia anual Consultas por BA (CIE) | 10,3% | 8,3 a 12,4% | 2/5 (a,b); incidencia anual; muestra aleatoria de consultas, selección de BA |
| Población <2 años 1993–004 | |||||||
| Yorita16 (2007 Hawai, EE.UU.) | P | Ec | Incidencia anual <1 año BA (CIE) | 1,51% | Factores de riesgo (sin palivizumab) códigos diagnósticos CIE. No se aclara si los porcentajes de BA e infecciones por VRS están solapados | ||
| Población <5 años 1997–004 | Incidencia anual <1 año Infección VRS | 0,98% | |||||
| Incidencia anual <5 años BA (CIE) | 0,38% | ||||||
| Incidencia anual <5 año Infección VRS | 0,27% | ||||||
A: ambulatorio; BA: bronquiolitis aguda; CIE: códigos de la clasificación internacional de enfermedades; CP: cohortes; CR: cohortes retrospectivo; E: entorno asistencial; Ec: estudio ecológico; EPC: enfermedad pulmonar crónica; ET: estudio transversal; D: diseño epidemiológico; H: hospital; IC95%: intervalo de confianza del 95%; IRA: infección respiratoria aguda; n: tamaño muestral; P: poblacional; SG: semanas de gestación; VRS: virus respiratorio sincitial.
En 16 estudios de casos y controles8,9,12,36–48, 9 estudios de cohortes prospectivos17–19,21,24,27,28,34,49 y 9 retrospectivos6,14,22,25,29–33 se han evaluado distintos factores de riesgo de ingreso (en su mayoría) o consulta12,14,44 por BA6,8,12,14,36–38,40,42,45,46, IRA baja28,41 o infección por VRS9,17–19,21,22,24,27,29–34,39,40,43,44,47–49, tanto en población general como en muestras seleccionadas de prematuros17,18,21,24,25,28,31,34,39,44,48,49. En la tabla 2 se presentan las características y los resultados simplificados de estos estudios. La calidad de los trabajos es media, con frecuente ajuste multivariante, aunque no siempre correcto. Los principales factores de riesgo evaluados han sido: displasia broncopulmonar o enfermedad pulmonar crónica, cardiopatía congénita, prematuridad, hermanos mayores (escolarizados o guardería), asistencia a guardería, convivientes, sexo masculino, raza o etnia, exposición a tabaco, edad al inicio de la epidemia y alta neonatal en periodo epidémico. Otros factores analizados han sido: duración de la lactancia materna, peso al nacimiento, anticuerpos frente a VRS maternos, sibilantes o atopia familiar, eccema o sibilantes previos, gemelaridad, familia monoparental, humedad, temperatura y polución ambiental, edad de la madre, resistencia pulmonar al nacimiento, medio rural, tipo de aseguradora sanitaria, síndrome de Down y nivel socioeconómico familiar.
Tabla simplificada de los trabajos sobre factores de riesgo de bronquiolitis aguda
| Comparación autor/año | n | E | D | Medida de efecto | RGC¿ | EE | Efecto | IC95% (p) | Calidad. Comentarios |
| Factores de riesgo de BA | |||||||||
| Spence36 (1996 Reino Unido) | 307/612 | H | CC | 2/5 (a,b); casos ingresados; controles de registro poblacional no ingresados | |||||
| Nivel económico bajo (IV y V) | Ingreso <1 año por BA (clínica) | OR | 1,67 | 1,25 a 2,24 | |||||
| Boyce6 (2000 EE.UU.) | 248.952 | P | CR | 3/5 (a,c,e); recién nacidos 1989–1993 (Medicaid) | |||||
| Cardiópatas | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 2,8 | 2,3 a 3,3 | ||||
| Displasia BP | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 10,7 | 8,4 a 13,6 | ||||
| Prematuros <28 SG | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 2,4 | 1,8 a 3,3 | ||||
| Prematuros 29–33 SG | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 2,2 | 1,8 a 2,7 | ||||
| Prematuros 33–36 SG | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,8 | 1,6 a 2,1 | ||||
| ≥Un hermano | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,4 | 1,3 a 1,5 | ||||
| Sexo masculino | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,3 | 1,2 a 1,4 | ||||
| Raza blanca | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,3 | 1,2 a 1,4 | ||||
| Medio rural | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,3 | 1,2 a 1,4 | ||||
| Tabaco materno | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,3 | 1,2 a 1,4 | ||||
| Educación materna <12 años | Ingreso <1 año por BA o IRA VRS+ | 3% | RRa | 1,2 | 1,1 a 1,3 | ||||
| Carbonell-Estrany21 (2000 España) | 680 | H | CP | 3/5 (a,c,d); prematuros ≤32 SG 25% etiología no determinada Excluidos casos sin VRS determinado | |||||
| Edad gestacional (semanas) | Ingreso por infección VRS | 9%¿ | ORa | 0,85 | 0,72 a 0,99 | ||||
| Enfermedad pulmonar crónica | Ingreso por infección VRS | 9%¿ | ORa | 3,1 | 1,22 a 7,91 | ||||
| Hermanos escolarizados | Ingreso por infección VRS | 9%¿ | ORa | 1,86 | 1,01 a 3,4 | ||||
| Pardo-Crespo37 (2000 España) | 392/493 | H | CC | 2/5 (b,e); casos ingresados Controles: selección de nacidos en el mismo periodo | |||||
| Fuma la madre | Ingreso <2 años por BA (CIE) | ORa | 1,71 | 0,80 a 3,69 | |||||
| Fuma la madre >19 cigarros | Ingreso <2 años por BA (CIE) | ORa | 2,70 | 1,00 a 7,31 | |||||
| Carbonell-Estrany34 (2001 España) | 1.206 | H | CP | 3/5 (a,c,d); prematuros ≤32 SG; 10% etiología no determinada | |||||
| Edad gestacional (semanas) | Ingreso por infección VRS | 11,8%¿ | ORa | 0,87 | 0,77 a 0,97 | ||||
| Edad >3 meses a inicio epidemia | Ingreso por infección VRS | 11,8%¿ | ORa | 0,44 | 0,25 a 0,77 | ||||
| Hermanos escolarizados | Ingreso por infección VRS | 11,8%¿ | ORa | 1,64 | 1,05 a 2,55 | ||||
| Exposición tabaco | Ingreso por infección VRS | 11,8%¿ | ORa | 1,63 | 1,05 a 2,56 | ||||
| Eriksson22 (2002 Suiza) | P | CR | 3/5 (a,c,d); años 1987–1998;subcohorte sin factores de riesgo | ||||||
| Hermanos mayores | 46.231 | Ingresos por infección por VRS | 1,1% | OR | 2,42 | 2,08 a 2,81 | Subco | ||
| Albernaz8 (2003 Brasil) | 655/655 | P | CC | 3/5 (a,b,e); recién nacidos en 1993 | |||||
| Sexo masculino vs femenino | Ingreso primer año por BA (CIE) | 2,1%¿ | OR | 1,28 | 0,87 a 1,87 | ||||
| Renta ≤1 vs >3 salario mínimo | Ingreso primer año por BA (CIE) | 2,1%¿ | OR | 2,35 | 1,31 a 3,21 | ||||
| Renta 1,1–3 vs >3 salario mínimo | Ingreso primer año por BA (CIE) | 2,1%¿ | OR | 1,93 | 3,16 a 4,21 | ||||
| Edad gestacional <37 SG vs. ≥37 | Ingreso primer año por BA (CIE) | 2,1%¿ | OR | 1,80 | 1,04 a 3,11 | ||||
| Tabaco materno: | Ingreso primer año por BA (CIE) | 2,1%¿ | OR | 1,57 | 1,01 a 2,43 | ||||
| Lactancia <1 mes | Ingreso primer año por BA (CIE) | 2,1%¿ | OR | 3,28 | 2,01 a 5,35 | ||||
| Cano Fernández38 (2003 España) | 123/327 | H | CC | 1/5 (a); casos ingreso por BA;controles ingresos por causa no respiratoria | |||||
| Madre fumadora en embarazo | Ingreso <2 años por BA | ORa | 3,27 | 1,39 a 7,71 | |||||
| Liese24 (2003 Alemania) | 1.103 | H | CP | 4/5 (a,b,d,e); nacidos ≤35 SG 1998–1999; Excluídos tratados con palivizumab | |||||
| Varón | Ingreso por IRA por VRS (probable) | 5,2%¿ | ORa | 8,7 | 2,6 a 29,1 | ||||
| Displasia broncopulmonar | Ingreso por IRA por VRS (probable) | 5,2%¿ | ORa | 3,99 | 1,4 a 11,2 | ||||
| Hermanos en guardería | Ingreso por IRA por VRS (probable) | 5,2%¿ | ORa | 3,9 | 1,9 a 8,3 | ||||
| Alta RN octubre a diciembre | Ingreso por IRA por VRS (probable) | 5,2%¿ | ORa | 2,1 | 0,99 a 4,4 | ||||
| Nielsen9 (2003 Dinamarca) | 6.260 | H | CC | 3/5 (a,b,c); población <2 años 1990–1994; casos (1.252) ingresados por infección por VRS (IFD); controles 5 poblacionales por caso; revisión de registros hospitalarios | |||||
| Prematuros ≤32 SG vs. >40 | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 3,88 | 2,74 a 7,75 | ||||
| Prematuros 33–35 SG vs. >40 | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,73 | 1,20 a 2,82 | Diferencia de edad con hermano mayor | |||
| Prematuros 35–37 SG vs. >40 | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,43 | 1,10 a 1,97 | ||||
| Nacidos 37–39 SG vs. >40 | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,18 | 1,00 a 1,40 | Análisis de anticuerpos maternos a VRS limitado a casos y controles <3 meses. | |||
| Peso RN <3kg vs. >4kg | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,42 | 1,10 a 1,98 | ||||
| Diferencia edad 1.er hermano 0–2 años (vs. no hermanos) | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,76 | 1,45 a 2,32 | ||||
| Diferencia edad 2–4 años | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,64 | 1,40 a 2,07 | ||||
| Diferencia edad >4 años: | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,23 | 1,01 a 1,56 | ||||
| Tabaquismo materno embarazo | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,56 | 1,32 a 1,98 | ||||
| Ac VRS madre <210 (vs. >330) | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,22 | 0,78 a 2,22 | ||||
| Ac VRS madre 210–275 | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,68 | 1,08 a 2,74 | ||||
| Ac VRS madre 275–330 | Ingreso <2 años por infección VRS | 1,9%¿ | ORa | 1,75 | 1,22 a 2,85 | ||||
| Pedersen25 (2003 Dinamarca) | 240 | H | CR | 1/5 (c); nacidos <28 SG o <1.000g 1994–1995; Escasa potencia del estudio. Grupo de alto riesgo basal | |||||
| Enfermedad pulmonar crónica | Ingreso <2 años por infección VRS | 16% | OR | 2,2 | 0,94 a 5,26 | ||||
| Alta neonatal agosto a octubre | Ingreso <2 años por infección VRS | OR | 2,0 | 1 a 3,9 | |||||
| Figueras-Aloy39 (2004 España) | 186/371 | H | CC | 4/5 (a,b,c,e); Prematuros 33–35 SG dados de alta con <6 meses al inicio epidemia 2002–2003; Excluidos casos con palivizumab y otros factores de riesgo | |||||
| Edad ≤10 sem. al inicio estación | Ingresos por IRA baja por VRS | ORa | 3,95 | 2,65 a 5,90 | |||||
| Lactancia materna ≤2 meses | Ingresos por IRA baja por VRS | ORa | 3,26 | 1,96 a 5,42 | |||||
| Hermanos en edad escolar | Ingresos por IRA baja por VRS | ORa | 2,85 | 1,88 a 4,33 | |||||
| Residentes/visitantes en casa ≥4 | Ingresos por IRA baja por VRS | ORa | 1,91 | 1,19 a 3,07 | |||||
| Sibilantes en la familia | Ingresos por IRA baja por VRS | ORa | 1,90 | 1,19 a 3,01 | |||||
| Boyce40 (2004 EE.UU.) | 280/560 | A | CC | 3/5 (a,b,e); casos <2 años ingresados por BA o por IRA VRS+; 2 controles aleatorio por caso | |||||
| Raza blanca | Ingreso por BA o IRA por VRS | ORa | 0,7 | 0,5 a 1,2 | |||||
| Hermanos | Ingreso por BA o IRA por VRS | ORa | 1,5 | 1,1 a 2,1 | Diagnósticos basados en códigos CIE | ||||
| Guardería | Ingreso por BA o IRA por VRS | ORa | 1,4 | 0,9 a 2,1 | Dudas sobre la validez de los diagnósticos (antecedente de asma) | ||||
| Exposición tabaco | Ingreso por BA o IRA por VRS | ORa | 1,6 | 1,1 a 2,4 | |||||
| Prematuridad <36 SG | Ingreso por BA o IRA por VRS | ORa | 4,3 | 2,4 a 7,8 | |||||
| Bajo peso <2.500g | Ingreso por BA o IRA por VRS | ORa | 4,0 | 2,4 a 6,7 | |||||
| Displasia broncopulmonar | Ingreso por BA o IRA por VRS | ORa | 22,4 | 1,2 a 406,2 | |||||
| Cardiopatía | Ingreso por BA o IRA por VRS | ORa | 2,3 | 1,1 a 4,9 | |||||
| Asma | Ingreso por BA o IRA por VRS | ORa | 32,8 | 7,9 a 136,5 | |||||
| Otras condiciones médicas | Ingreso por BA o IRA por VRS | ORa | 2,6 | 1,8 a 3,7 | |||||
| Retraso en vacunación | Ingreso por BA o IRA por VRS | ORa | 2,7 | 1,6 a 4,7 | |||||
| Duppenthaler27 (2004 Suiza) | 54.925 | P | CP | 3/5 (a,c,d); cohorte no expuesta: nacidos sin cardiopatía o con cardiopatía hemodinámicamente no significativa | |||||
| Cardiopatía hem. significativa | 396 | Ingreso <1 año por IRA por VRS | 1,2% | RR | 1,6 | 0,8 a 3,2 | |||
| Ingreso 1–2 años por IRA por VRS | 0,2% | RR | 2,7 | 0,7 a 9,7 | |||||
| Goetghebuer41 (2004 Reino Unido) | 140/356 | H | CC | 3/5 (b,d,e) | |||||
| Cuestionario a casos y 2 controles por caso obtenidos de base de datos hospitalaria, con bajo porcentaje de respuestas (59% de casos y 53% de controles) | |||||||||
| Asma materno | Ingreso <1 año por IRA baja | ORa | 1,90 | 0,99 a 3,65 | |||||
| Ingreso neonatal | Ingreso <1 año por IRA baja | ORa | 3,11 | 1,65 a 5,85 | |||||
| Lactancia maternal | Ingreso <1 año por IRA baja | ORa | 0,54 | 0,33 a 0,89 | |||||
| Orden nacimiento 1.° vs. otro | Ingreso <1 año por IRA baja | ORa | 0,35 | 0,20 a 0,60 | |||||
| Niño asmático | Ingreso <1 año por IRA baja | ORa | 3,77 | 1,87 a 7,58 | |||||
| Eccema en niño | Ingreso <1 año por IRA baja | ORa | 3,74 | 1,25 a 11,2 | |||||
| Lacaze-Masmonteil28 2004 Francia | 2.370 | H | CP | 3/5 (a,c,d); nacidos <33 SG en 2000 Excluidos casos con palivizumab | |||||
| Embarazo sencillo vs múltiple | Ingreso por IRA baja (epidemia) | 15%¿ | ORa | 1,5 | 1,1 a 2 | ||||
| Prematuro <31 SG | Ingreso por IRA baja (epidemia) | 15%¿ | ORa | 1,6 | 1,3 a 2 | ||||
| Hermanos en casa | Ingreso por IRA baja (epidemia) | 15%¿ | ORa | 1,8 | 1,4 a 2,3 | ||||
| Retardo crecimiento intrauterine | Ingreso por IRA baja (epidemia) | 15%¿ | ORa | 1,7 | 1,2 a 2,5 | ||||
| Familia monoparental (madre) | Ingreso por IRA baja (epidemia) | 15%¿ | ORa | 1,8 | 1,3 a 2,7 | ||||
| Law17 (2004 Canadá) | 1.860 | H | CP | 4/5 (a,c,d,e); nacidos 33–35 SG 2001–2003; Excluídos tratados con palivizumab | |||||
| Asistencia guardería | Ingreso por IRA baja VRS+ | ORa | 12,32 | 2,56 a 59,34 | |||||
| Nacimiento noviembre a enero | Ingreso por IRA baja VRS+ | ORa | 4,89 | 2,57 a 9,29 | |||||
| Hermanos preescolares | Ingreso por IRA baja VRS+ | ORa | 2,76 | 1,51 a 5,03 | |||||
| Peso al nacimiento | Ingreso por IRA baja VRS+ | ORa | 2,19 | 1,14 a 4,22 | |||||
| Sexo masculino | Ingreso por IRA baja VRS+ | ORa | 1,91 | 1,10 a 3,31 | |||||
| >2 fumadores en domicilio | Ingreso por IRA baja VRS+ | ORa | 1,87 | 1,07 a 3,26 | |||||
| >5 personas en domicilio | Ingreso por IRA baja VRS+ | ORa | 1,79 | 1,02 a 3,16 | |||||
| Historia de familiar de eccema | Ingreso por IRA baja VRS+ | ORa | 0,42 | 0,18 a 0,99 | |||||
| Hekkinen29 (2005 Finlandia) | 35.811 | H | CR | 3/5 (a,c,d); nacidos 1991–2000 | |||||
| Enfermedad pulmonar crónica | Ingreso <2 años infección por VRS | 2,1%¿ | RR | 6,3 | 2,2 a 18,2 | ||||
| Prematuro <32 SG sin EPC | Ingreso <2 años infección por VRS | 2,1%¿ | RR | 3,6 | 2,7 a 4,8 | ||||
| Prematuro 33–35 SG | Ingreso <2 años infección por VRS | 2,1%¿ | RR | 1,9 | 1,4 a 2,6 | ||||
| Broughton18 (2005 Reino Unido) | 126 | H | CP | 2/5 (a,c); prematuros <32 SG | |||||
| Madre fumadora en embarazo | IRA baja VRS+ | 35%¿ | OR | 4,85 | 1,61 a 14,58 | ||||
| Hermanos escolarizados (n.°) | IRA baja VRS+ | 35%¿ | OR | 1,54 | 1,03 a 2,06 | ||||
| Lapeña42 (2005 España) | H | CC | 3/5 (a,b,d); 82 sem. con BA (casos); 92 sem. sin BA (controles); 221 BA | ||||||
| Humedad absoluta | Semanas con vs. sin BA | ORa | 0,68 | 0,55 a 0,83 | |||||
| Temperatura basal | Semanas con vs. sin BA | ORa | 0,85 | 0,78 a 0,94 | Correlación inversa | ||||
| Mansbach12 (2005 USA) | 100/100 | A | CC | 1/5 (e); población <2 años 1992–2000; muestra aleatoria de visitas a Urgencias, selección de BA; | |||||
| Sexo masculino | Consultas a urgencias por BA (CIE) | 2,6% | ORa | 1,3 | 1,04 a 1,7 | ||||
| Raza negra vs. blanca | ORa | 1,1 | 0,8 a 1,4 | ||||||
| Raza otras vs. blanca | ORa | 1,4 | 0,8 a 2,4 | ||||||
| Etnia hispano vs. no hispana | ORa | 1,7 | 1,2 a 2,2 | ||||||
| Etnia mestizo vs no hispana | ORa | 0,9 | 0,6 a 1,3 | ||||||
| Reeve43 (2006 Australia) | 271/542 | H | CC | 3/5 (a,b,e); controles: nacidos en el mismo centro y época | |||||
| Peso al nacer 2.000–2.499g | Ingreso <3 años por IRA baja VRS+ | ORa | 2,3 | 1,3 a 4,0 | |||||
| Peso al nacer <2.000g | Ingreso <3 años por IRA baja VRS+ | ORa | 3,1 | 1,7 a 5,6 | |||||
| Hijo previo | Ingreso <3 años por IRA baja VRS+ | ORa | 1,6 | 1,2 a 2,2 | |||||
| Madre soltera | Ingreso <3 años por IRA baja VRS+ | ORa | 1,6 | 1,1 a 2,2 | |||||
| Broughton44 (2006 Reino Unido) | 15/24 | H | CC | 2/5 (a,d); prematuros <32 SG; casos IRA baja VRS+ (15) Controles IRA baja VRS- (15) o sin IRA (9) | |||||
| Resistencia pulmonar alta (36 sem. edad posconcepcional) | IRA baja VRS+ | ORa | 1,3 | 1,10 a 1,50 | |||||
| Cilla30 (2006 España) | 13.986 | H | CR | 1/5 (a); recién nacidos 1996–2000; | |||||
| Cardiopatía hemod. Inestable | Ingresos<2años por infección VRS | 2,5%¿ | ORa | 12,77 | 3,89 a 41,89 | Datos de exposición en no ingresados extraído de instituto de estadística | |||
| Madre<25a | Ingresos<2años por infección VRS | 2,5%¿ | ORa | 2,28 | 1,60 a 3,23 | Análisis en una submuestra de riesgo asociado a exposición a tabaco no valorable | |||
| Rural-suburbano/Urbano: | Ingresos<2años por infección VRS | 2,5%¿ | ORa | 1,32 | 1,05 a 1,65 | ||||
| Peso nacimiento <2.500g | Ingresos<2años por infección VRS | 2,5%¿ | ORa | 2,24 | 1,53 a 3,28 | ||||
| Nacimiento 2.° semestre | Ingresos<2años por infección VRS | 2,5%¿ | ORa | 2,09 | 1,66 a 2,62 | ||||
| Edad gestacional <37 SG | Ingresos<2años por infección VRS | 2,5%¿ | ORa | 1,61 | 1,07 a 2,42 | ||||
| Doering31 (2006 Alemania y Austria) | 1.158 | H | CR | 2/5 (a,c); prematuros 29-35 SG | |||||
| Problemas neurológicos | Ingreso por infección VRS probable | 4,9%¿ | ORa | 3,6 | 1,3 a 9,9 | ||||
| Varón | Ingreso por infección VRS probable | 4,9%¿ | ORa | 2,8 | 16 a 5,5 | ||||
| Hermanos mayores | Ingreso por infección VRS probable | 4,9%¿ | ORa | 1,7 | 1,0 a 3,2 | ||||
| Alta entre octubre a noviembre | Ingreso por infección VRS probable | 4,9%¿ | ORa | 1,7 | 0,9 a 3,1 | ||||
| Karr45 (2006 EE.UU.) | 18.595 | H | CC | 2/5 (a,c); casos ingresados por BA (CIE); los controles son los casos en días Diferentes a los previos al ingreso | |||||
| Polución ambiental a 1–2 días | Ingreso por BA (CIE) | OR | 0,96 | 0,94 a 0,99 | |||||
| Polución ambiental a 3–5 días | Ingreso por BA (CIE) | OR | 0,98 | 0,96 a 1,00 | |||||
| Polución ambiental a 6–8 días | Ingreso por BA (CIE) | OR | 0,96 | 0,93 a 0,98 | |||||
| Rietveld32 (2006 Holanda) | 140.661 | P | CR | 4/5 (a,c,d,e); Nacidos <1 año (<2 si DBP) 1996–1998; | |||||
| Sexo masculino | Ingreso <2 años por infección VRS | 1,7% | ORa | 1,4 | 1,3 a 1,5 | Patrón mensual de infección VRS (octubre-abril): considerada variable continua; no se presentan detalles | |||
| Prematuro ≤28 SG (vs. ≥37 SG) | Ingreso <2 años por infección VRS | 1,7% | ORa | 3,2 | 2,1 a 4,8 | ||||
| Prematuro 29–32 SG | Ingreso <2 años por infección VRS | 1,7% | ORa | 2,8 | 2,1 a 3,8 | Modelo predictivo: área bajo la curva: 0,80; para edad gestacional <33 y <37 sem. 0,75 y 0,80 respectivamente | |||
| Prematuro 33–34 SG | Ingreso <2 años por infección VRS | 1,7% | ORa | 2,3 | 1,8 a 3,0 | ||||
| Prematuro 35–36 SG | Ingreso <2 años por infección VRS | 1,7% | ORa | 1,6 | 1,3 a 1,9 | Modelo no validado | |||
| Peso nacer ≤2.500 (vs. >3.000g) | Ingreso <2 años por infección VRS | 1,7% | ORa | 1,7 | 1,5 a 2,0 | ||||
| Peso nacer 2.501–3.000g | Ingreso <2 años por infección VRS | 1,7% | ORa | 1,3 | 1,1 a 1,4 | ||||
| Displasia broncopulmonar (DBP) | Ingreso <2 años por infección VRS | 1,7% | ORa | 2,2 | – | ||||
| Edad (meses) sin DBP | Ingreso <2 años por infección VRS | 1,7% | ORa | 0,8 | 0,8 a 0,8 | ||||
| Edad (meses) con BPD | Ingreso <2 años por infección VRS | 1,7% | ORa | 0,9 | 0,9 a 1,0 | ||||
| Sangare33 (2006 EE.UU.) | P | CR | 2/5 (a,c); nacidos en 1999–2003 en California; | ||||||
| Raza afroamericanos (vs. blancos no hispanos) | Ingreso <1 año infección VRS (CIE) | 1,71% | RR | 1,22 | 1,17 a 1,27 | Medical (variante de Medicaid); análisis del efecto de la aseguradora por razas resultados parecidos Esta variable sugiere influencia de nivel socioeconómico o diferencias asistenciales | |||
| Raza hispanos | Ingreso <1 año infección VRS (CIE) | 1,71% | RR | 1,15 | 1,13 a 1,18 | ||||
| Raza nativos o indios de Alaska | Ingreso <1 año infección VRS (CIE) | 1,71% | RR | 0,62 | 0,52 a 0,74 | ||||
| Raza asiáticos/islas del Pacífico | Ingreso <1 año infección VRS (CIE) | 1,71% | RR | 0,43 | 0,41 a 0,45 | ||||
| Aseguradora MediCal vs. otras | Ingreso <1 año infección VRS (CIE) | 1,71% | RR | 2,03 | 1,99 a 2,06 | ||||
| Bloemers19 (2007 Holanda) | 241/276 | A | CP | 2/5 (a,c); IA en S. Down (9,9%); no control multivariante de otros factores | |||||
| S. Down | Ingreso por IRA baja por VRS | 0,7% | OR | 8,99 | 5,11 a 15,81 | (cardiopatía, prematuridad) | |||
| Carrol14 (2007 EE.UU.) | 101.245 | P | CR | 2/5: (c,e); recién nacidos (Medicaid) sin factores de riesgo (sin palivizumab) | |||||
| Madres fumadoras y asmáticas | Consultas <1 año por BA (CIE) | 20%¿ | ORa | 1,47 | 1,36 a 1,59 | ||||
| Ingreso <1año por BA (CIE) | ORa | 1,71 | 1,48 a 1,97 | Riesgo de ingreso no detallado; riesgo de ingreso >3 días 2,26%; factores de riesgo de ingreso >3 días similares | |||||
| Madres asmáticas | Consultas <1 año por BA (CIE) | 20%¿ | ORa | 1,39 | 1,30 a 1,48 | ||||
| Ingreso <1año por BA (CIE) | ORa | 1,74 | 1,55 a 1,96 | ||||||
| Madres fumadoras | Consultas <1 año por BA (CIE) | 20%¿ | ORa | 1,14 | 1,10 a 1,18 | ||||
| Ingreso <1año por BA (CIE) | ORa | 1,28 | 1,20 a 1,36 | ||||||
| Karr46 (2007 EE.UU.) | 188.067 | H | CC | 3/5 (a,b,c); nacidos 1995–2000; casos 18.595; 10 controles por caso | |||||
| Partículas <2,5μm (10μg/m3) | Ingreso por BA (CIE) | OR | 1,09 | 1,04 a 1,14 | |||||
| Rossi47 (2007 Italia) | 145/292 | U | CC | 2/5 (a,e); casos IRA baja VRS+ que ingresan; controles: IRA baja VRS- de Urgencias que no ingresan | |||||
| Edad inicio epidemia 6–11 meses (vs. >12 meses) | Ingreso <3 años por IRA baja VRS+ | ORa | 2,47 | 0,88 a 6,93 | |||||
| Edad 3–5 meses | Ingreso <3 años por IRA baja VRS+ | ORa | 4,15 | 1,51 a 11,45 | |||||
| Edad <3 meses | Ingreso <3 años por IRA baja VRS+ | ORa | 8,46 | 3,09 a 23,19 | |||||
| Peso al nacer 1.500–2.499g (vs. >2.500g) | Ingreso <3 años por IRA baja VRS+ | ORa | 2,43 | 1,29 a 4,60 | |||||
| Peso al nacer <1.500g | Ingreso <3 años por IRA baja VRS+ | ORa | 7,70 | 1,29 a 45,91 | |||||
| Orden de hijos 2.° o más | Ingreso <3 años por IRA baja VRS+ | ORa | 1,92 | 1,21 a 3,09 | |||||
| Figueras-Aloy48 (2008 España) | 5.441 | H | CC | 4/5 (a,b,c,e); prematuros 33–35 SG dados de alta con <6 meses al inicio epidemias 2005–2007 Excluidos casos con otros factores de riesgo | |||||
| Edad ≤10 sem. a inicio estación | Ingresos por IRA baja por VRS | 3,7%¿ | ORa | 2,99 | 2,23 a 4,01 | ||||
| Hermanos escolares o guardería | Ingresos por IRA baja por VRS | 3,7%¿ | ORa | 2,04 | 1,53 a 2,74 | ||||
| Tabaco durante embarazo | Ingresos por IRA baja por VRS | 3,7%¿ | ORa | 1,61 | 1,16 a 2,25 | ||||
| Sampalis49 (2008 Canadá/España) | 1.860 | H | CP | 4/5 (a,c,d,e); modelo predictivo de ingreso por IRA baja por VRS en prematuros de 33–5 SG ≤6 meses al inicio estaciónDiseño en cohorte PICNIC (1.860), validación en cohorte FLIP (186) | |||||
| Pequeño para edad gestacional (12 puntos) | Ingreso epidemia 1.ª IRA baja VRS+ | β | 0,797 | ||||||
| Sexo masculino (11 p) | Ingreso epidemia 1.ª IRA baja VRS+ | β | 0,700 | ||||||
| Nacido estación VRS (25 p) | Ingreso epidemia 1ª IRA baja VRS+ | β | 1,598 | Puntuación máxima 100; riesgo bajo 0–48, moderado 49–64 y alto 65–100 | |||||
| No eccema en familia (12 p) | Ingreso epidemia 1ª IRA baja VRS+ | β | 0,797 | ||||||
| Guardería niño/ hermano (17 p) | Ingreso epidemia 1.ª IRA baja VRS+ | β | 1,067 | Validez predictiva: en muestra de derivación: Se 68,2%; Es 71,9%; Curva ROC: 0,76 (0,70 a 0,82); en muestra de validación: Se 61,3% (54,3 a 68,3); Es 65,8% (60,9 a 70,6); curva ROC: 0,70 (0,65 a 0,74). | |||||
| >5 residentes en casa (13 p) | Ingreso epidemia 1.ª IRA baja VRS+ | β | 0,798 | ||||||
| >1 fumador en casa (10 p) | Ingreso epidemia 1.ª IRA baja VRS+ | β | 0,657 | ||||||
A: ambulatorio; BA: bronquiolitis aguda; CC: casos y controles/cohorte control o controles; CIE: códigos de la clasificación internacional de enfermedades; CP: cohortes; CR: cohortes retrospectivo; E: entorno asistencial; EE: estimador de efecto; D: diseño epidemiológico; H: hospital; IC95%: intervalo de confianza del 95%; IRA: infección respiratoria aguda; n: tamaño muestral; OR: odds ratio ORa: odds ratio ajustado; p: significación estadística; P: poblacional; RGC: riesgo grupo control; RR: riesgo relativo; SG: semanas de gestación; VRS: virus respiratorio sincitial; vs. : grupo comparado; β: coeficiente de regresión.
Una revisión sistemática50 ha analizado la estacionalidad de la infección por VRS en distintas áreas geográficas. Varios estudios22,51 han analizado las variaciones anuales de inicio e intensidad de las epidemias de ingresos por infección por VRS. Alonso et al52 han analizado las tendencias de comienzo y final de las epidemias de BA en un área de Castilla y León. Jhonson et al53 han comparado el riesgo de ingreso de los casos con BA atendidos en servicios de Urgencias de un hospital pediátrico y otro general.
Consistencia entre estudiosExiste una importante heterogeneidad entre los resultados de los distintos estudios. Aunque podrían existir variaciones entre épocas, sistemas sanitarios o regiones geográficas en el riesgo de BA, la principal fuente de heterogeneidad radica en que la mayoría de los trabajos emplean como medida de riesgo el ingreso hospitalario. La aplicación de diferentes criterios de indicación de ingreso va a reflejarse en estimaciones de riesgo heterogéneas. Los pacientes ingresados solo representan un pequeño porcentaje del total de BA, no recogiendo en todas las series el mismo espectro de pacientes. Otra fuente de heterogeneidad se debe al empleo de diferentes criterios de definición de caso: criterios clínicos, revisión de códigos diagnósticos del alta hospitalaria, infecciones por VRS identificadas mediante pruebas microbiológicas, revisión de bases de datos, etc.
Estimación de sesgosLas estimaciones de frecuencia y de riesgo encontradas en los distintos estudios, están sujetas a diversos tipos de sesgos. En primer lugar han podido producirse sesgos de selección, por la incorporación a las muestras de estudio de pacientes atendidos a nivel hospitalario con mayor grado de afectación que el conjunto de casos con BA. Asimismo, en los estudios en los que se han empleado los códigos diagnósticos del alta hospitalaria como fuente de casos ha podido incurrirse en sesgos de clasificación. De igual manera en los trabajos en los que solo se han contabilizado las infecciones por VRS, una realización selectiva de las pruebas microbiológicas ha podido distorsionar las estimaciones de riesgo. Por último, a pesar de que se han realizado ajustes multivariantes en los estudios sobre factores de riesgo de BA, no siempre se han considerado en los ajustes todas las variables de interés; de hecho, no ha sido habitual controlar diferencias de nivel socioeconómico.
Precisión de las estimacionesEl número de trabajos existente y el relativamente amplio tamaño muestral de algunos de ellos permite asumir la precisión de las estimaciones realizadas, tanto de medidas de frecuencia como de medidas de riesgo.
Intensidad del efecto o fuerza de la asociaciónEl riesgo de ingreso por BA en los dos primeros años de vida varía entre épocas, áreas geográficas y sistemas sanitarios, en un intervalo situado entre 1 y 3,5%4–16. El riesgo de ingreso por IRA por VRS (en su mayoría IRA de vías bajas) se sitúa en un intervalo inferior (entre 0,8 y 2,5%)6,16–33. Los estudios que han valorado la tendencia desde los años 80 a finales de los 90 del siglo pasado, han observado que las tasas de ingreso se han duplicado, tanto de BA4 como de infecciones por VRS22. Del conjunto de casos diagnosticados de IRA de vías bajas, las BA constituyen un amplio porcentaje con una gran variación entre un 40 y 80%, mientras que las infecciones por VRS suponen aproximadamente el 50%, tanto de las BA como de las IRA bajas. Cuando se diferencian los ingresos por años, el riesgo en el primer año de vida es entre 4 y 6 veces mayor que en el segundo año6,13. La frecuencia de ingreso publicada en nuestro país oscila para la BA entre 1,1 y 3,5% y para las IRA por VRS entre 1,4 y 2,5%5,7,13,26. Las estimaciones de frecuencia de consultas y urgencias se basan en la revisión de bases de datos de sistemas sanitarios de Estados Unidos, situándose en un intervalo entre el 4 y el 20% para consultas y en el 2,6% (un solo estudio) para urgencias. Considerando estos datos, menos del 10% de los casos de BA requerirían ingreso (un solo estudio).
La frecuencia de BA en población de riesgo, muestra importantes diferencias entre estudios5–7,11,17–23,25,27–32,35. Para población de riesgo la frecuencia recogida en la mayoría de los estudios se refiere a ingresos por IRA por VRS, situándose para prematuros de (32 semanas de gestación [SG] entre el 4,4 y el 18%; en estos estudios las IRA por VRS suponían aproximadamente la mitad de los ingresos por problemas respiratorios. Los prematuros entre 33 y 35 SG tienen una frecuencia de ingreso por IRA por VRS entre 5,7 y 7,9%. Los estudios referidos a población española sitúan la frecuencia de ingreso por BA en 10,6% para ≤32 SG y 7,9% entre 33 y 35 SG5. La estimación del grupo IRIS de frecuencia de ingreso por IRA por VRS para prematuros de ≤32 SG es del 11,8% (20,7% para ingreso por problema respiratorio)34. Otro estudio nacional sobre muestras más pequeñas sitúan la frecuencia de ingreso por IRA por VRS en 4,4% para ≤32 SG y 7,8% entre 33 y 35 SG30. Para niños con displasia broncopulmonar el intervalo de frecuencias es muy amplio entre 7,3 y 42% (lo que sugiere una importante heterogeneidad en la clasificación de este factor de riesgo), para niños con enfermedad pulmonar crónica entre el 6 y 12%. A nivel nacional contamos con una estimación de frecuencia de ingreso sobre una muestra pequeña de niños con displasia broncopulmonar del 42%5. Para niños con cardiopatías congénitas la frecuencia de ingreso por BA o IRA por VRS se sitúa entre 1,6 y 9,8% (entre el 2 y el 9,8% para cardiopatías hemodinámicamente significativas, complejas o con hiperaflujo); la única estimación publicada en España en niños sin inmunoprofilaxis se refiere a frecuencia de ingreso por BA en cardiópatas con hiperaflujo pulmonar que se sitúa en el 9,8%5.
En población general se han encontrado diversos factores de riesgo de ingreso por BA, IRA baja o infección por VRS. Un primer grupo de factores están presentes en la mayoría de los estudios y conllevan un incremento de riesgo medio-alto: la displasia broncopulmonar (intervalo de RR u OR: 2,2 a 22,4), la enfermedad pulmonar crónica (2,2 a 6,3), la cardiopatía congénita (2,3 a 2,8), la cardiopatía hemodinámicamente inestable (12,7), la prematuridad en conjunto (1,6 a 4,3) o por tramos de edad gestacional <28 SG (2,4 a 3,2), entre 29 y 32 SG (2,2 a 3,8), entre 33 y 35 SG (1,7 a 2,0), entre 35 y 37 SG (1,4), la existencia de hermanos mayores (1,4 a 2,4) y la exposición a tabaco en la gestación (1,5 a 3,2). La edad al inicio de la epidemia ha sido considerada en unos pocos trabajos mostrando riesgos medios-altos con una cierta tendencia: para <3 meses (2,9 a 8,4), 3–5 meses (4,1), 6–11 meses (2,4), nacimiento en periodo preepidémico (2). Algunos factores parcialmente relacionados con los anteriores son: bajo peso al nacimiento (1,4 a 4,0), peso al nacimiento <1.500g (7,7), ingreso neonatal (3,1) y síndrome de Down (8,9). Otros factores menos constantes o que se asocian a un discreto incremento de riesgo son: exposición a tabaco (intervalo de RR o OR: 0,8–2,7), sexo masculino (0,8–1,7), bajo nivel socioeconómico (1,6 a 2,3), medio rural (1,3), bajo nivel de educación materna (1,2), lactancia materna <1 mes (2,0 a 3,2), bajos títulos de anticuerpos maternos frente a VRS (1,6 a 1,7), humedad o temperatura ambiental (0,6 a 0,8), raza afroamericana o etnia hispana (estudios en EE.UU.: 1,1 a 1,7), madre soltera (1,6) y madre <25 años (2,2). Algunos de estos factores podrían ser indicadores de nivel socioeconómico, variable potencialmente relacionada con la indicación de ingreso. Asimismo, los antecedentes personales de eccema o sibilantes se han encontrado en algún estudio asociados a mayor riesgo de ingreso por IRA de vías bajas, aunque esta asociación ofrece dudas de su aplicabilidad al conjunto de BA; de hecho, los antecedente familiares de atopia (eccema o asma) han mostrado resultados contradictorios, a favor y en contra del riesgo de ingreso.
En niños prematuros los principales factores de riesgo son: displasia broncopulmonar o enfermedad pulmonar crónica (intervalo de RR u OR: 2,2 a 3,9), alta neonatal entre agosto y octubre o edad <10–12 semanas al inicio de la epidemia (2,0 a 4,8), sexo masculino (1,9 a 8,7), hermanos escolarizados (1,6 a 3,9) y exposición a tabaco en la gestación (1,6 a 4,8). Otros factores menos constantes en los diversos estudios son: exposición a tabaco (intervalo de RR u OR: 1,6 a 1,8). Lactancia materna <2 meses (3,2), ≥4 convivientes (1,9), gemelaridad (1,5), bajo peso al nacimiento o retardo de crecimiento intrauterino (1,7 a 2,1), familia monoparental (1,8), asistencia a guardería (12,3) y antecedente de problemas neurológicos (3,6).
Se ha desarrollado y tratado de validar un modelo predictivo de ingreso por primera IRA baja por VRS en niños entre 33 y 35 SG49. Este modelo emplea una escala de 100 puntos que incluye las variables: pequeño para la edad gestacional, sexo masculino, nacimiento en época epidémica, no antecedente de eccema en la familia, asistencia a guardería del niño o hermanos, >5 convivientes y exposición a tabaco. En el estudio de validación este modelo mostró una limitada utilidad predictiva (sensibilidad 61%, especificidad 66%; área bajo la curva ROC 0,70).
En un pequeño grupo de prematuros de <32 SG, se ha encontrado asociación entre alta resistencia pulmonar a las 36 semanas de edad postgestacional y desarrollo posterior de IRA baja por VRS44.
Erikson et al22 han observado que en Suiza las epidemias de ingresos por infección por VRS alternan anualmente entre epidemias de comienzo precoz e intensas con otras de comienzo tardío y leves. Terletskaia-Ladwig51 han encontrado en Alemania una alternancia similar. Alonso et al52 han encontrado en un área de Castilla y León ciclos epidémicos de BA anuales y cada 6 años, con comienzo predominante en octubre y final en febrero.
Jhonson et al53, han comparado los casos de BA atendidos en servicios de Urgencias de un hospital pediátrico y otro general, encontrando que en el hospital pediátrico ingresan menos (25 vs. 37%) y tienen más criterios de gravedad.
En una revisión sistemática50 se ha analizado la estacionalidad de la infección por VRS en distintas áreas geográficas. En las regiones ecuatoriales hay casos durante todo el año, con un discreto aumento durante 7 meses. En Norteamérica las epidemias se inician de septiembre a enero, más tarde cuanto más al norte. En Centroamérica y Sudamérica se inician de diciembre a mayo, más tarde cuanto más al sur. En Europa de octubre a enero (comienzan antes alrededor del mar Báltico). En África varía de sur a norte; en Sudáfrica suele iniciarse en enero, retrasándose el inicio según se asciende, para pasar a estar todo el año en las zonas ecuatoriales. En el sur de Asia y alrededor del pacífico el comienzo suele ser en marzo y los meses siguientes (en Australia marzo y abril).
Grado de relación con las preguntas clínicasPodemos considerar la evidencia sobre riesgo de BA de carácter indirecto, principalmente, porque la mayoría de los estudios emplean una medida de efecto intermedia (ingreso hospitalario), pero también por mezclar casos con diagnóstico clínico heterogéneo de BA junto a IRA de vías bajas o infecciones respiratorias en general por VRS.
Validez externa y aplicabilidad de la evidenciaLa información existente, tanto a nivel nacional como internacional, sobre el riesgo de BA parece aplicable a nuestro medio. No obstante, para poder emplear las estimaciones de frecuencia o riesgo en la toma de decisiones convendría disponer de estimaciones realizadas en nuestro entorno. Por otra parte, los resultados de los estudios dedicados a casos de infección por VRS podrían no ser directamente aplicables al conjunto de BA.
Con respecto a los factores de riesgo de ingreso por BA, no contamos con información sobre la utilidad predictiva de dichas variables. Aunque la presencia de dichos factores incrementa el riesgo, no parecen lo suficientemente sensibles o específicos, como para su aplicación en la práctica clínica para la selección de pacientes candidatos a intervenciones preventivas. Otro aspecto a tener en cuenta es que por las características de la medida de efecto (ingreso hospitalario) no podemos distinguir los factores que predisponen a formas graves de BA, de los que influyen directamente sobre la decisión de ingreso (factores sociofamiliares y económicos). Un factor asociado a formas graves de BA debería influir no sólo en el riesgo de ingreso sino también en otros indicadores clínicos de gravedad.
Balance coste-beneficio-riesgoNo existe información al respecto.
Estimación del impacto de futuros estudiosEs previsible que la realización de estudios observacionales sobre cohortes de población general o de pacientes de alto riesgo en nuestro medio ofrezca información epidemiológica útil para la planificación de recursos sanitarios. Considerando la incorporación de la profilaxis con palivizumab en población de alto riesgo, es probable que las estimaciones de riesgos se vean modificadas por dicha intervención.
Perfil etiológico de la bronquiolitis aguda y patrones clínicos asociadosLa información sobre el perfil etiológico de las BA debe proceder de estudios observacionales con muestras de pacientes representativas y no sesgadas, con criterios de inclusión apropiados y métodos de identificación microbiológicos válidos adecuadamente aplicados. Para evaluar los patrones clínicos asociados a cada agente etiológico se deben considerar estudios de cohortes, casos y controles o estudios transversales que evalúen de forma independiente antecedentes, clínica y evolución de cada grupo de pacientes, estimando la validez y contribución de cada parámetro, su capacidad predictiva y su rendimiento clínico.
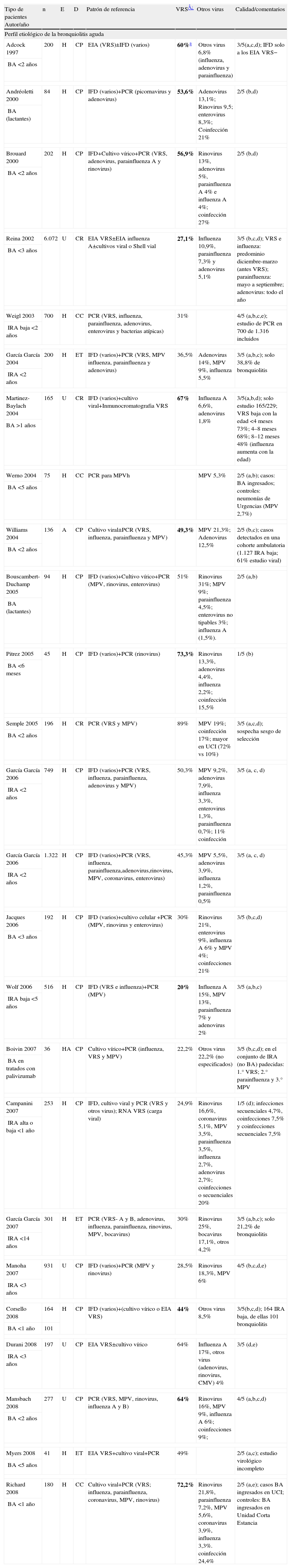
Volumen de la evidenciaEl perfil etiológico de las BA se ha evaluado en múltiples trabajos, aunque la heterogeneidad de las muestras estudiadas y, especialmente, de los métodos microbiológicos empleados origina que la información disponible sea difícil de sintetizar. Los trabajos publicados en la última década se caracterizan por haber incorporado técnicas de reacción en cadena de la polimerasa (PCR), que han modificado el perfil etiológico de la enfermedad, tanto cualitativa (porcentaje de VRS identificados) como cualitativamente (otros virus implicados).
La frecuencia de infección por VRS y otros virus respiratorios en niños pequeños con BA o con IRA de vías bajas ha sido estimada en 15 estudios de cohortes prospectivos54–68, 3 de cohortes retrospectivos69–71, 3 de casos y controles72–74 y 3 estudios transversales75–77. En la tabla 3 se presentan las principales características y resultados de dichos estudios. Pocos estudios detallan claramente los criterios diagnósticos de BA, siendo frecuente que no se excluyan casos con sibilantes previos. La mayoría de las muestras corresponden a pacientes ingresados, en 7 trabajos se incluyen pacientes atendidos en Urgencias o ambulatorios57,63,65,67–70. Los tamaños muestrales de los trabajos oscilaron entre 36 y 6.072 pacientes (mediana 196,5; media 516,5), y su diseño presentó una calidad media. Los patrones de referencia microbiológicos incluían pruebas de detección antigénica (en su mayoría inmunofluorescencia directa para varios virus respiratorios), cultivo viral y técnicas de PCR; solo en un estudio no se realizó cultivo o PCR54 y, en otros 3, no se realizó a la muestra completa57,67,69. El espectro de virus analizado mediante PCR fue muy variado, tanto desde el punto de vista de los virus analizados como desde los métodos empleados, reflejando la falta de estandarización de estas técnicas.
Tabla simplificada de evidencias de los trabajos sobre perfil etiológico de la bronquiolitis aguda
| Tipo de pacientes Autor/año | n | E | D | Patrón de referencia | VRS¿ | Otros virus | Calidad/comentarios |
| Perfil etiológico de la bronquiolitis aguda | |||||||
| Adcock 1997 | 200 | H | CP | EIA (VRS)±IFD (varios) | 60%a | Otros virus 6,8% (influenza, adenovirus y parainfluenza) | 3/5(a,c,d); IFD solo a los EIA VRS− |
| BA <2 años | |||||||
| Andréoletti 2000 | 84 | H | CP | IFD (varios)+PCR (picornavirus y adenovirus) | 53,6% | Adenovirus 13,1%; Rinovirus 9,5; enterovirus 8,3%; Coinfección 21% | 2/5 (b,d) |
| BA (lactantes) | |||||||
| Brouard 2000 | 202 | H | CP | IFD+Cultivo vírico+PCR (VRS, adenovirus, parainfluenza A y rinovirus) | 56,9% | Rinovirus 13%, adenovirus 5%, parainfluenza A 4% e influenza A 4%; coinfección 27% | 2/5 (b,d) |
| BA <2 años | |||||||
| Reina 2002 | 6.072 | U | CR | EIA VRS±EIA influenza A±cultivos viral o Shell vial | 27,1% | Influenza 10,9%, parainfluenza 7,3% y adenovirus 5,1% | 3/5 (b,c,d); VRS e influenza: predominio diciembre-marzo (antes VRS); parainfluenza: mayo a septiembre; adenovirus: todo el año |
| BA <3 años | |||||||
| Weigl 2003 | 700 | H | CC | PCR (VRS, influenza, parainfluenza, adenovirus, enterovirus y bacterias atípicas) | 31% | 4/5 (a,b,c,e); estudio de PCR en 700 de 1.316 incluidos | |
| IRA baja <2 años | |||||||
| García García 2004 | 200 | H | ET | IFD (varios)+PCR (VRS, MPV influenza, parainfluenza y adenovirus) | 36,5% | Adenovirus 14%, MPV 9%, influenza 5,5% | 3/5 (a,b,c); solo 38,8% de bronquiolitis |
| IRA <2 años | |||||||
| Martinez-Baylach 2004 | 165 | U | CR | IFD (varios)+cultivo viral+Inmunocromatografia VRS | 67% | Influenza A 6,6%, adenovirus 1,8% | 3/5(a,b,d); solo estudio 165/229; VRS baja con la edad <4 meses 73%; 4–8 meses 68%; 8–12 meses 48% (influenza aumenta con la edad) |
| BA >1 años | |||||||
| Werno 2004 | 75 | H | CC | PCR para MPVh | MPV 5,3% | 2/5 (a,b); casos: BA ingresados; controles: neumonías de Urgencias (MPV 2,7%) | |
| BA <5 años | |||||||
| Williams 2004 | 136 | A | CP | Cultivo viral±PCR (VRS, influenza, parainfluenza y MPV) | 49,3% | MPV 21,3%; Adenovirus 12,5% | 2/5 (b,c); casos detectados en una cohorte ambulatoria (1.127 IRA baja; 61% estudio viral) |
| BA <2 años | |||||||
| Bouscambert-Duchamp 2005 | 94 | H | CP | IFD (varios)+Cultivo vírico+PCR (MPV, rinovirus, enterovirus) | 51% | Rinovirus 31%; MPV 9%; parainfluenza 4,5%; enterovirus no tipables 3%; influenza A (1,5%). | 2/5 (a,b) |
| BA (lactantes) | |||||||
| Pitrez 2005 | 45 | H | CP | IFD (varios)+PCR (rinovirus) | 73,3% | Rinovirus 13,3%, adenovirus 4,4%, influenza 2,2%; coinfección 15,5% | 1/5 (b) |
| BA <6 meses | |||||||
| Semple 2005 | 196 | H | CR | PCR (VRS y MPV) | 89% | MPV 19%; coinfección 17%; mayor en UCI (72% vs 10%) | 3/5 (a,c,d); sospecha sesgo de selección |
| BA <2 años | |||||||
| García García 2006 | 749 | H | CP | IFD (varios)+PCR (VRS, influenza, parainfluenza, adenovirus y MPV) | 50,3% | MPV 9,2%, adenovirus 7,9%, influenza 3,3%, enterovirus 1,3%, parainfluenza 0,7%; 11% coinfección | 3/5 (a, c, d) |
| IRA <2 años | |||||||
| García García 2006 | 1.322 | H | CP | IFD (varios)+PCR (VRS, influenza, parainfluenza,adenovirus,rinovirus, MPV, coronavirus, enterovirus) | 45,3% | MPV 5,5%, adenovirus 3,9%, influenza 1,2%, parainfluenza 0,5% | 3/5 (a, c, d) |
| IRA <2 años | |||||||
| Jacques 2006 | 192 | H | CP | IFD (varios)+cultivo celular +PCR (MPV, rinovirus y enterovirus) | 30% | Rinovirus 21%, enterovirus 9%, influenza A 6% y MPV 4%; coinfecciones 21% | 3/5 (b,c,d) |
| BA <3 años | |||||||
| Wolf 2006 | 516 | H | CP | IFD (VRS e influenza)+PCR (MPV) | 20% | Influenza A 15%, MPV 13%, parainfluenza 7% y adenovirus 2% | 3/5 (a,b,c) |
| IRA baja <5 años | |||||||
| Boivin 2007 | 36 | HA | CP | Cultivo vírico+PCR (influenza, VRS y MPV) | 22,2% | Otros virus 22,2% (no especificados) | 3/5 (b,c,d); en el conjunto de IRA (no BA) padecidas: 1.° VRS; 2.° parainfluenza y 3.° MPV |
| BA en tratados con palivizumab | |||||||
| Campanini 2007 | 253 | H | CP | IFD, cultivo viral y PCR (VRS y otros virus); RNA VRS (carga viral) | 24,9% | Rinovirus 16,6%, coronavirus 5,1%, MPV 3,5%, parainfluenza 3,5%, influenza 2,7%, adenovirus 2,7%; coinfecciones o secuenciales 20% | 1/5 (d); infecciones secuenciales 4,7%, coinfecciones 7,5% y coinfecciones secuenciales 7,5% |
| IRA alta o baja <1 año | |||||||
| García García 2007 | 301 | H | ET | PCR (VRS- A y B, adenovirus, influenza, parainfluenza, rinovirus, MPV, bocavirus) | 30% | Rinovirus 25%, bocavirus 17,1%, otros 4,2% | 3/5 (a,b,c); solo 21,2% de bronquiolitis |
| IRA <14 años | |||||||
| Manoha 2007 | 931 | U | CP | IFD (varios)+PCR (MPV y rinovirus) | 28,5% | Rinovirus 18,3%, MPV 6% | 4/5 (b,c,d,e) |
| IRA <3 años | |||||||
| Corsello 2008 | 164 | H | CP | IFD (varios)+(cultivo vírico o EIA VRS) | 44% | Otros virus 8,5% | 3/5(b,c,d); 164 IRA baja, de ellas 101 bronquiolitis |
| BA <1 año | 101 | ||||||
| Durani 2008 | 197 | U | CP | EIA VRS±cultivo vírico | 64% | Influenza A 17%, otros virus (adenovirus, rinovirus, CMV) 4% | 3/5 (d,e) |
| IRA <3 años | |||||||
| Mansbach 2008 | 277 | U | CP | PCR (VRS, MPV, rinovirus, influenza A y B) | 64% | Rinovirus 16%, MPV 9%, influenza A 6%; coinfecciones 9%; | 4/5 (a,b,c,d) |
| BA <2 años | |||||||
| Myers 2008 | 41 | H | ET | EIA VRS+cultivo viral+PCR | 49% | 2/5 (a,c); estudio virológico incompleto | |
| BA <5 años | |||||||
| Richard 2008 | 180 | H | CC | Cultivo viral+PCR (VRS; influenza, parainfluenza, coronavirus, MPV, rinovirus) | 72,2% | Rinovirus 21,8%, parainfluenza 7,2%, MPV 5,6%, coronavirus 3,9%, influenza 3,3%. coinfección 24,4% | 2/5 (a,e); casos BA ingresados en UCI; controles: BA ingresados en Unidad Corta Estancia |
| BA <1 año | |||||||
BA: bronquiolitis aguda; CC: casos y controles/cohorte control o controles; CP: cohortes; CR: cohortes retrospectivo; E: entorno asistencial; EIA: enzimoinmunoanálisis; ET: estudio transversal; D: diseño epidemiológico; H: hospital; IFD: inmunofluorescencia directa; IRA: infección respiratoria aguda; MPV: metapneumovirus; n: tamaño muestral; PCR: reacción en cadena de la polimerasa; U: Servicio de Urgencias; VRS: virus respiratorio sincitial; vs.: grupo comparado; β: coeficiente de regresión; ρ: coeficiente de correlación; ±: técnica utilizada de forma selectiva.
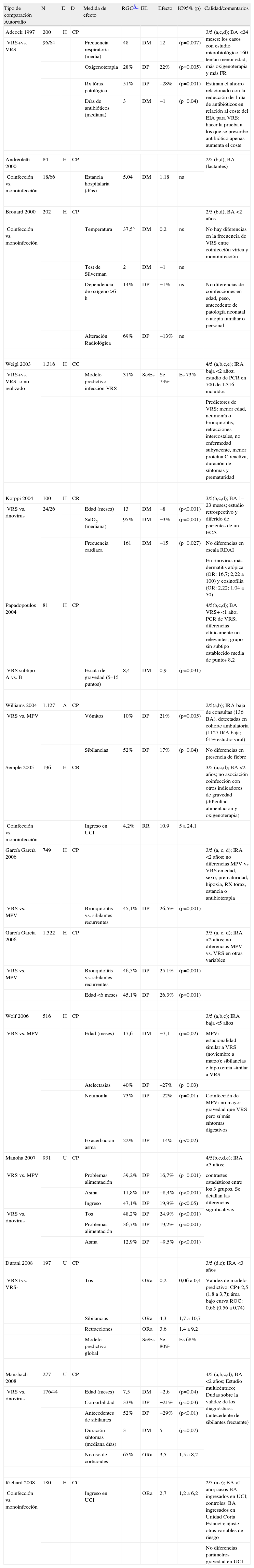
En once estudios de cohortes prospectivos, 2 de cohortes retrospectivos y 2 de casos y controles, se ha comparado el perfil clínico de las BA o IRA de vías bajas en niños pequeños, en función de la etiología. Así, se han comparado los casos con y sin VRS54,67,72, los casos con coinfección o monoinfección vírica55,71,74,78, los casos con VRS respecto otros virus específicos (MVP57,59,60,62,65, rinovirus65,68,79) y los subtipos de VRS A y B entre sí80. En la tabla 4 se presentan las principales características y resultados de dichos estudios. La calidad de los estudios es media, sin el empleo de técnicas de enmascaramiento, con posibles sesgos en la selección de pacientes en función de la disponibilidad de estudios microbiológicos y sin apenas uso de ajustes multivariantes. Los tamaños muestrales oscilaron entre 81 y 1.322 pacientes (mediana 202).
Tabla simplificada de evidencias sobre patrones clínicos asociados al perfil etiológico de la bronquiolitis aguda
| Tipo de comparación Autor/año | N | E | D | Medida de efecto | RGC¿ | EE | Efecto | IC95% (p) | Calidad/comentarios |
| Adcock 1997 | 200 | H | CP | 3/5 (a,c,d); BA <24 meses; los casos con estudio microbiológico 160 tenían menor edad, más oxigenoterapia y más FR | |||||
| VRS+vs. VRS- | 96/64 | Frecuencia respiratoria (media) | 48 | DM | 12 | (p=0,007) | |||
| Oxigenoterapia | 28% | DP | 22% | (p=0,005) | |||||
| Rx tórax patológica | 51% | DP | –28% | (p=0,001) | Estiman el ahorro relacionado con la reducción de 1 día de antibióticos en relación al coste del EIA para VRS: hacer la prueba a los que se prescribe antibiótico apenas aumenta el coste | ||||
| Días de antibióticos (mediana) | 3 | DM | −1 | (p=0,04) | |||||
| Andréoletti 2000 | 84 | H | CP | 2/5 (b,d); BA (lactantes) | |||||
| Coinfección vs. monoinfección | 18/66 | Estancia hospitalaria (días) | 5,04 | DM | 1,18 | ns | |||
| Brouard 2000 | 202 | H | CP | 2/5 (b,d); BA <2 años | |||||
| Coinfección vs. monoinfección | Temperatura | 37,5° | DM | 0,2 | ns | No hay diferencias en la frecuencia de VRS entre coinfección vírica y monoinfección | |||
| Test de Silverman | 2 | DM | −1 | ns | |||||
| Dependencia de oxígeno >6h | 14% | DP | −1% | ns | No diferencias de coinfecciones en edad, peso, antecedente de patología neonatal o atopia familiar o personal | ||||
| Alteración Radiológica | 69% | DP | −13% | ns | |||||
| Weigl 2003 | 1.316 | H | CC | 4/5 (a,b,c,e); IRA baja <2 años; estudio de PCR en 700 de 1.316 incluídos | |||||
| VRS+vs. VRS- o no realizado | Modelo predictivo infección VRS | 31% | Se/Es | Se 73% | Es 73% | ||||
| Predictores de VRS: menor edad, neumonía o bronquiolitis, retracciones intercostales, no enfermedad subyacente, menor proteína C reactiva, duración de síntomas y prematuridad | |||||||||
| Korppi 2004 | 100 | H | CR | 3/5(b,c,d); BA 1–23 meses; estudio retrospectivo y diferido de pacientes de un ECA | |||||
| VRS vs. rinovirus | 24/26 | Edad (meses) | 13 | DM | −8 | (p<0,001) | |||
| SatO2 (mediana) | 95% | DM | −3% | (p=0,001) | |||||
| Frecuencia cardiaca | 161 | DM | −15 | (p=0,027) | No diferencias en escala RDAI | ||||
| En rinovirus más dermatitis atópica (OR: 16,7; 2,22 a 100) y eosinofilia (OR: 2,22; 1,04 a 50) | |||||||||
| Papadopoulos 2004 | 81 | H | CP | 4/5(b,c,d); BA VRS+ <1 año; PCR de VRS; diferencias clínicamente no relevantes; grupo sin subtipo establecido media de puntos 8,2 | |||||
| VRS subtipo A vs. B | Escala de gravedad (5–15 puntos) | 8,4 | DM | 0,9 | (p=0,031) | ||||
| Williams 2004 | 1.127 | A | CP | 2/5(a,b); IRA baja de consultas (136 BA), detectadas en cohorte ambulatoria (1127 IRA baja; 61% estudio viral) | |||||
| VRS vs. MPV | Vómitos | 10% | DP | 21% | (p=0,005) | ||||
| Sibilancias | 52% | DP | 17% | (p=0,04) | No diferencias en presencia de fiebre | ||||
| Semple 2005 | 196 | H | CR | 3/5 (a,c,d); BA <2 años; no asociación coinfección con otros indicadores de gravedad (dificultad alimentación y oxigenoterapia) | |||||
| Coinfección vs. monoinfección | Ingreso en UCI | 4,2% | RR | 10,9 | 5 a 24,1 | ||||
| García García 2006 | 749 | H | CP | 3/5 (a, c, d); IRA <2 años; no diferencias MPV vs VRS en edad, sexo, prematuridad, hipoxia, RX tórax, estancia o antibioterapia | |||||
| VRS vs. MPV | Bronquiolitis vs. sibilantes recurrentes | 45,1% | DP | 26,5% | (p=0,001) | ||||
| García García 2006 | 1.322 | H | CP | 3/5 (a, c, d); IRA <2 años; no diferencias MPV vs. VRS en otras variables | |||||
| VRS vs. MPV | Bronquiolitis vs. sibilantes recurrentes | 46,5% | DP | 25,1% | (p=0,001) | ||||
| Edad <6 meses | 45,1% | DP | 26,3% | (p=0,001) | |||||
| Wolf 2006 | 516 | H | CP | 3/5 (a,b,c); IRA baja <5 años | |||||
| VRS vs. MPV | Edad (meses) | 17,6 | DM | −7,1 | (p=0,02) | MPV: estacionalidad similar a VRS (noviembre a marzo); sibilancias e hipoxemia similar a VRS | |||
| Atelectasias | 40% | DP | –27% | (p=0,03) | |||||
| Neumonía | 73% | DP | –22% | (p=0,01) | Coinfección de MPV: no mayor gravedad que VRS pero sí más síntomas digestivos | ||||
| Exacerbación asma | 22% | DP | –14% | (p<0,02) | |||||
| Manoha 2007 | 931 | U | CP | 4/5(b,c,d,e); IRA <3 años; | |||||
| VRS vs. MPV | Problemas alimentación | 39,2% | DP | 16,7% | (p=0,001) | contrastes estadísticos entre los 3 grupos. Se detallan las diferencias significativas | |||
| Asma | 11,8% | DP | −8,4% | (p<0,001) | |||||
| Ingreso | 47,1% | DP | 19,9% | (p<0,05) | |||||
| VRS vs. rinovirus | Tos | 48,2% | DP | 24,9% | (p<0,001) | ||||
| Problemas alimentación | 36,7% | DP | 19,2% | (p=0,001) | |||||
| Asma | 12,9% | DP | −9,5% | (p<0,001) | |||||
| Durani 2008 | 197 | U | CP | 3/5 (d,e); IRA <3 años | |||||
| VRS+vs. VRS- | Tos | ORa | 0,2 | 0,06 a 0,4 | Validez de modelo predictivo: CP+ 2,5 (1,8 a 3,7); área bajo curva ROC: 0,66 (0,56 a 0,74) | ||||
| Sibilancias | ORa | 4,3 | 1,7 a 10,7 | ||||||
| Retracciones | ORa | 3,6 | 1,4 a 9,2 | ||||||
| Modelo predictivo global | Se/Es | Se 80% | Es 68% | ||||||
| Mansbach 2008 | 277 | U | CP | 4/5 (a,b,c,d); BA <2 años; Estudio multicéntrico; Dudas sobre la validez de los diagnósticos (antecedente de sibilantes frecuente) | |||||
| VRS vs. rinovirus | 176/44 | Edad (meses) | 7,5 | DM | −2,6 | (p=0,04) | |||
| Comorbilidad | 33% | DP | −21% | (p=0,03) | |||||
| Antecedentes de sibilantes | 52% | DP | −29% | (p<0,01) | |||||
| Duración síntomas (mediana días) | 3 | DM | 5 | (p=0,07) | |||||
| No uso de corticoides | 65% | ORa | 3,5 | 1,5 a 8,2 | |||||
| Richard 2008 | 180 | H | CC | 2/5 (a,e); BA <1 año; casos BA ingresados en UCI; controles: BA ingresados en Unidad Corta Estancia; ajuste otras variables de riesgo | |||||
| Coinfección vs. monoinfección | Ingreso en UCI | ORa | 2,7 | 1,2 a 6,2 | |||||
| No diferencias parámetros gravedad en UCI | |||||||||
A: ambulatorio; BA: bronquiolitis aguda; CC: casos y controles/cohorte control o controles; CP: cohortes; CR: cohortes retrospectivo; E: entorno asistencial; ECA: ensayo clínico aleatorizado; EE: estimador de efecto; EIA: enzimoinmunoanálisis; D: diseño epidemiológico; DM: diferencia de medias; DP: diferencia de porcentajes; H: hospital; IC95%: intervalo de confianza del 95%; IFD: inmunofluorescencia directa; IRA: infección respiratoria aguda; MPV: metapneumovirus; n: tamaño muestral; ns: no significativo; OR: odds ratio ORa: odds ratio ajustado; p: significación estadística; RDAI: respiratory distress assessment instrument; RGC: riesgo grupo control; RR: riesgo relativo; RX radiografía; U: Servicio de Urgencias; UCI: Unidad de Cuidados Intensivos; VRS: virus respiratorio sincitial; vs.: grupo comparado.
Cosnes-Lambe et al81 estudiaron la prevalencia de infección por Bordetella pertusis en pacientes menores de 4 meses ingresados por IRA, con o sin VRS.
Garofalo et al82 han comparado el perfil clínico de IRA de pacientes con infección por VRS y virus de la influenza. Tres trabajos83–85, han evaluado la presencia de coinfección por metapneumovirus (MPV) en pacientes con BA por VRS ingresados en UCI.
Consistencia entre estudiosAunque el VRS es el agente dominante identificado en todas las series revisadas, existen variaciones importantes tanto en la frecuencia de infección por VRS, como en el resto de virus respiratorios identificados, en relación con los diferentes perfiles epidemiológicos de los pacientes y los variados métodos microbiológicos empleados. En cuanto a los estudios sobre perfil clínico asociados a los distintos agentes etiológicos, los resultados parecen consistentes en cuanto a dirección, aunque no en cuanto a magnitud, de los parámetros relacionados.
Estimación de sesgosExiste un riesgo moderado de sesgos de selección, por la inclusión diferencial de pacientes con muestras respiratorias disponibles, probablemente relacionada con la selección de casos con mayor afectación. En algunos estudios, en los que se han empleado técnicas rápidas de detección antigénica, los resultados de estas pruebas han podido originar sesgos de incorporación diferencial. Varios estudios han utilizado patrones de referencia microbiológicos incompletos o con realización selectiva de técnicas de confirmación54,57,67,69, que han podido provocar una distorsión en las estimaciones de frecuencia. Es posible que la falta de estandarización de las técnicas de PCR haya ocasionado algún sesgo de clasificación, aunque es poco probable que dicho sesgo haya sido diferencial.
Precisión de las estimacionesLas estimaciones de frecuencia de infección por VRS se basan en muestras suficientemente grandes como para considerarlas precisas. Sin embargo, las series revisadas han podido ofrecer frecuencias algo imprecisas para otros virus respiratorios menos frecuentes. Igualmente, los parámetros clínicos asociados a perfiles etiológicos parecen aceptablemente precisos, aunque el volumen de evidencia disponible para algunos patrones clínicos es escaso como para juzgar su precisión.
Intensidad del efecto o fuerza de la asociaciónEl VRS es el agente dominante identificado en todas las series revisadas54–77. La frecuencia de infección por VRS en niños pequeños con BA o con IRA de vías bajas presenta grandes variaciones, en relación con los diferentes perfiles epidemiológicos de los pacientes y los variados métodos microbiológicos empleados. Presentan mayor frecuencia los trabajos con pacientes ingresados y de menor edad, con diagnóstico de BA, así como los que emplean técnicas de PCR. Considerando exclusivamente las muestras de menores de 2 años con BA ingresados, la media y mediana de infección por VRS es del 56% y el intervalo de valores oscila entre 27 y 73% (el conjunto de trabajos tienen una media y mediana de 47 y 49%). Para los trabajos con pacientes ambulatorios o de urgencias la media baja hasta el 51%, pero no la mediana.
El porcentaje de BA con virus identificado en los trabajos en que se ha recurrido a técnicas de PCR no supera habitualmente el 75–80%; algún estudio ha encontrado porcentajes mayores71, aunque existen dudas sobre la posible existencia de sesgos de selección. Los estudios que utilizaron como patrón de referencia el cultivo viral, alcanzan porcentajes de identificación etiológica menores. Además del VRS, los virus principalmente identificados han sido los rinovirus (10–30% de los casos), adenovirus (2–14%), MPV (3,5–21%), influenza (2–10%), parainfluenza (0,5–7%), enterovirus (1,3–9%) y bocavirus. Entre el 9 y el 27% de los casos se identifica más de un virus en las muestras respiratorias (coinfección). Las grandes diferencias encontradas en el perfil etiológico pueden reflejar la variada epidemiología geográfica y temporal de las IRA, aunque en gran parte se deben a los cambios en la búsqueda selectiva de determinados virus.
Con respecto a las variaciones estacionales, en nuestro país se han documentado picos de incidencia de infección por VRS, MPV y virus de la influenza entre los meses de diciembre a marzo, con un inicio más precoz de los VRS, con respecto a los otros; para los virus parainfluenza se ha observado un predominio de mayo a septiembre y para los adenovirus una distribución homogénea a lo largo del año59,69.
Los casos de BA con VRS54 presentan una mayor frecuencia respiratoria, requieren suplementos de oxígeno más prolongados, tienen menos hallazgos en la radiografía de tórax y se asocian a un menor uso de antibióticos (en un solo estudio una mediana de ahorro de un día). No obstante, no se ha demostrado que el ahorro de antibióticos sea relevante, dado que se trata de un tratamiento innecesario en la BA. También se ha evaluado el perfil de los casos con VRS entre lactantes con IRA, en general67,72, encontrando asociación entre la identificación de VRS y menor edad, mayor presencia de sibilancias y tiraje, menor proteína C reactiva, mayor duración de síntomas y prematuridad. No obstante, la capacidad predictiva de dichas variables resultaba limitada cuando se consideraban en conjunto (sensibilidades 73–80% y especificidades 68–73%), y no se ha analizado su rendimiento clínico sobre el paciente.
En 2 estudios retrospectivos71,74, se ha encontrado una asociación entre coinfección vírica e ingreso en UCI (riesgo entre 2 y 10 veces mayor), aunque dicho riesgo no se acompañaba de efecto en otros parámetros de gravedad. De hecho, otros 2 trabajos no han encontrado diferencias relacionadas con la presencia de coinfección55,78. En varias series de pacientes con BA por VRS ingresados en UCI e intubados tenían un 68–70% de coinfección por MPV71,83,84; en contraste, un pequeño estudio con el mismo tipo de pacientes no encontró ningún MPV asociado85.
En varios trabajos con niños pequeños con IRA57,59,60,62,65 se ha encontrado que el diagnóstico de BA era más frecuente en las IRA por VRS que en las IRA por MPV. El hallazgo de MPV se asoció a diagnóstico de sibilantes recurrentes, asma o neumonía. Otras diferencias observadas podrían estar en relación con la menor edad de los pacientes con VRS, como el mayor riesgo de ingreso, vómitos o problemas de alimentación. La inclusión de sibilantes recurrentes en estos trabajos limita la aplicabilidad externa de estos hallazgos al conjunto de BA.
Algo parecido se ha observado al comparar tanto las BA68,79 como las IRA65 relacionadas con VRS y rinovirus; los casos con VRS tenían menor edad, menos comorbilidad previa, menos antecedentes de sibilantes, menor saturación de oxígeno, más vómitos o problemas de alimentación, más duración de síntomas y menor uso de corticoides. Al igual que con las infecciones por MPV, las diferencias de edad con los casos por VRS, podrían explicar algunas de las diferencias clínicas, lo que limita la utilidad de la identificación etiológica sobre el manejo clínico de los pacientes.
La información sobre patrones clínicos asociados a subtipos de infección por VRS no parece tener magnitud ni relevancia clínica80.
Cosnes-Lambe et al81 estudiaron la prevalencia de infección por B. pertusis mediante PCR en pacientes menores de cuatro meses ingresados por IRA (incluyendo BA) con o sin VRS. El 16% de los casos con VRS tenían coinfección por B. pertusis, por un 20% de los casos sin VRS. Clínicamente los casos coinfectados tenían más tos y vómitos.
Garofalo et al82, han comparado el perfil clínico de IRA de pacientes con infección por VRS y virus de la influenza, encontrando que los casos con influenza y bronquiolitis con hipoxia tenían una edad media mayor que el resto de IRA.
Grado de relación con la pregunta clínicaLas estimaciones de perfil etiológico de las BA pueden ser consideradas directas, dado que las muestras analizadas y los métodos microbiológicos son apropiados, aunque existen algunas limitaciones metodológicas. Sin embargo, la evidencia relacionada con el perfil clínico de los distintos virus implicados solo puede ser considerada indirecta, por no haberse evaluado de forma válida la utilidad clínica de la identificación de dichos perfiles clínicos, utilizando medidas de impacto sobre los pacientes.
Validez externa y aplicabilidad de la evidenciaLa información disponible parece aplicable a nuestro medio, aunque es previsible que el perfil etiológico en nuestro entorno presente algunas diferencias, especialmente para los virus respiratorios menos frecuentes. La escasa información existente sobre etiología de las BA e IRA de vías bajas en el lactante en nuestro entorno resulta concordante con lo observado en otras áreas59,60,69,70,76. Sin embargo, los resultados referidos a perfil clínico no han probado suficientemente su validez ni mostrado utilidad práctica como para ser aplicables en la clínica.
Balance riesgo-beneficio-coste:No existe información sobre la relación coste-beneficio de la identificación etiológica en los pacientes con BA. Se ha evaluado en un estudio nacional el coste de la realización de pruebas de detección antigénica de VRS y virus de la influenza, en relación con el porcentaje de positivos, pero no al beneficio de dichos diagnósticos. Aunque la identificación de VRS se ha asociado a menor uso de antibióticos54, la reducción del empleo de antibióticos en los pacientes con BA esta suficientemente justificada incluso en ausencia de identificación etiológica.
Estimación del impacto de futuros estudiosSería conveniente disponer de más información sobre el perfil etiológico y clínico de los pacientes con BA en nuestro medio, con estudios de cohortes, bien diseñados, empleando técnicas microbiológicas sensibles, y medidas de efecto de interés clínico.
DocumentalistasMaría García-Puente Sánchez. Hospital de Torrevieja. Alicante.
Beatriz Muñoz Martín. Complejo Asistencial de Zamora. Zamora.
FinanciaciónFinanciado con una beca de la Fundación Hospital Torrevieja (código de protocolo: BECA0001).
Conflictos de interesesTodos los autores implicados en la elaboración de este documento han realizado una declaración explícita de los conflictos de intereses por escrito. No constan conflictos de intereses que puedan influir en el contenido de este documento. No obstante, algunos autores (JFS, JMEB y SLLA) han declarado su participación en ponencias, congresos y proyectos patrocinados por distintas empresas de la industria farmacéutica relacionadas con el tema tratado (ALK-Abelló, GSK y MSD, fundamentalmente).
Jesús Ma Andrés de Llano, Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia.
María Aparicio Rodrigo, Centro de Salud Entrevías, Área 1 de Atención Primaria, SERMAS, Madrid.
Ana Fe Bajo Delgado, Servicio de Pediatría, Hospital Virgen Concha, Zamora.
Albert Balaguer, Servicio de Pediatría, Hospital General de Catalunya, Universitat Internacional de Catalunya, Barcelona.
Antonio Bonillo, Servicio de Pediatría, Hospital de Torrecárdenas, Almería.
José Cristóbal Buñuel Álvarez, Centro de Salud, ABS Girona-4. ICS, Gerona.
Andrés Canut Blasco, Sección Microbiología, Hospital Santiago Apóstol, Osakidetza-Servicio Vasco de Salud, Vitoria.
José María Eiros Bouza, Servicio de Microbiología, Hospital Clínico Universitario de Valladolid, Facultad de Medicina de Valladolid, Valladolid.
Jordi Fàbrega Sabaté, Servicio de Pediatría, Hospital Universitari Germans Trias i Pujol, Badalona.
José Elviro Fernández Alonso, Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia.
Mercedes Fernández Rodríguez, Centro de Salud EAP Potes, SERMAS, Madrid.
Santiago Lapeña López de Armentia, Servicio de Pediatría, Complejo Asistencial de León, León.
Javier López Ávila, Centro de Salud San Bernardo Oeste, Salamanca.
Cristina Molinos Norniella, Servicio de Pediatría, Hospital de Cabueñes, Gijón.
Gloria Orejón de Luna, Centro de Salud General Ricardos, Área 11 de Atención Primaria, SERMAS, Madrid.
Svetlana Todorcevic, Servicio de Pediatría, Hospital Materno Infantil de Gran Canaria, Las Palmas de Gran Canaria.
Avalado por la Asociación Española de Pediatría (AEP), Asociación Española de Pediatría de Atención Primaria (AEPAP), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), Sociedad Española de Urgencias Pediátricas (SEUP), Sociedad Española de Infectología Pediátrica (SEIP), Sociedad Española de Neumología Pediátrica (SENP), Sociedad Española de Inmunología Clínica y Alergia Pediátrica (SEICAP), Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), Sociedad Española de Neonatología (SEN), Sociedad Española de Cardiología Pediátrica (SECPCC).