La alimentación infantil en los primeros meses/años de vida condiciona la salud a corto y largo plazo. La lactancia materna es la alimentación ideal por sus innumerables beneficios. Sin embargo, cuando no es posible la alimentación con leche materna, las fórmulas infantiles constituyen la mejor alternativa. El objetivo del estudio fue definir el papel de las fórmulas de inicio y continuación para lactantes mediante la opinión de un panel de expertos en gastroenterología y nutrición infantil.
Material y métodosEncuesta realizada mediante el método Delphi por 48 especialistas en pediatría y nutrición infantil. El cuestionario constaba de 62 ítems, estratificados en 5 bloques, sobre aspectos nutricionales de las fórmulas infantiles.
ResultadosSe consensuó el 64,6% de los ítems, estableciéndose un acuerdo no unificado respecto a aspectos nutricionales y su impacto sobre el desarrollo corporal, cerebral y la maduración inmune.
ConclusionesSegún los expertos encuestados, existe consenso sobre la adecuada composición en lípidos, lactosa, calcio, vitamina D y prebióticos, de las fórmulas infantiles, para el correcto desarrollo cerebral, inmunitario y somático. No hubo consenso en aspectos aún no bien definidos, como la calidad nutricional de las proteínas, la utilización de espesantes y la suplementación con taurina, probióticos y simbióticos. Son necesarios más estudios que determinen estos aspectos.
Infant feeding in the first months/years of life affects the health in the short and long term. Breastfeeding is the perfect food due to its many benefits. However, when breastfeeding is not possible, infant formulas are the best alternative. The aim of this study is to define the role of the supplemented formulas in infant nutrition using the opinion of a panel of experts in infant gastroenterology and nutrition.
Material and methodsA survey, using 62 items, stratified into 5 blocks, was performed by 48 panelists using the Delphi method to achieve a professional criteria consensus on nutritional aspects of infant formulas.
ResultsA consensus was reached in 64.6% of the items, with a non-unified agreement being established as regards the nutritional aspects of infant formulas, and their influence in body and brain development and immune maturity.
ConclusionsAccording to the experts surveyed, there is consensus as regards the suitable composition of lipids, lactose, calcium, vitamin D, and prebiotics in infant formulas, for a correct cerebral, immune and somatic development. There was no consensus on the not yet well-defined subjects, such as nutritional quality of proteins, use of thickeners, taurine supplementation, probiotic, and symbiotic aspects. More studies are necessary to confirm these subjects.
La alimentación infantil en los primeros meses/años de vida condiciona en gran medida el estado de salud a corto y largo plazo1. La Organización Mundial de la Salud recomienda la lactancia materna exclusiva durante los 6 primeros meses de vida, complementándose posteriormente con la alimentación adecuada hasta al menos los 2 años de edad2. La lactancia materna es ideal por sus innumerables beneficios: protege frente a infecciones, promueve el neurodesarrollo y reduce la presión arterial/colesterol y el riesgo posterior de padecer diabetes/obesidad1. Sin embargo, existen circunstancias en las que es necesario complementar o suplir la lactancia materna.
Durante los primeros años de vida, un porcentaje elevado de niños reciben alimentación con fórmulas infantiles. La United States Food and Drug Administration estima que el 40, el 50 y >75% de los bebés reciben fórmulas infantiles con 3, 6 y 12 meses, respectivamente3.
Para acercarse lo más posible a la leche materna, en la última década las fórmulas infantiles se han suplementado con ingredientes funcionales: ácidos grasos poliinsaturados, beta-palmitato, nucleótidos, prebióticos, probióticos, simbióticos, carnitina, taurina, etc., convirtiéndose así estas fórmulas en «alimentos funcionales».
Para determinar la relevancia clínica y la seguridad de los suplementos se han realizado diferentes estudios, la mayoría financiados por compañías de nutrición infantil, con pocos sujetos, periodo de seguimiento corto o metodología poco consistente4. Por ello, aún se cuestionan sus efectos beneficiosos, más allá de los nutricionales, sobre alergias, intolerancia a la lactosa, infecciones respiratorias/digestivas, cólicos del lactante, hipercolesterolemia, etc. En el caso de la suplementación con prebióticos y/o probióticos, el Comité de Nutrición de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition considera necesario llevar a cabo más estudios para definir las cantidades óptimas, la duración recomendable, los posibles riesgos/beneficios a largo plazo, el uso en poblaciones especiales, etc.4,5.
Debido a estas incertidumbres, y al elevado porcentaje de población infantil que recibe estos preparados, es importante clarificar aspectos sobre su calidad, seguridad y beneficios (corto/largo plazo). El objetivo de este estudio es conocer la opinión de expertos en gastroenterología y nutrición infantil acerca de determinados aspectos controvertidos sobre las fórmulas infantiles, especialmente en áreas sin suficientes estudios científicos. El grado de consenso nos permitirá identificar si existe un criterio uniforme de actuación y detectar áreas de mejora.
Materiales y métodosPara desarrollar este estudio se empleó el método Delphi modificado en 2 rondas: técnica estructurada de consenso profesional, variante del procedimiento original6, manteniendo sus ventajas primordiales, pero sin sus principales inconvenientes.
El proyecto constaba de 4 fases: 1) constitución de un comité científico (n=5) responsable de la dirección del proyecto; 2) selección de un panel de expertos (48 pediatras) en nutrición y gastroenterología infantil; 3) elaboración y envío de una encuesta electrónica en 2 rondas, y 4) análisis y valoración de resultados y elaboración de conclusiones.
Un equipo técnico dirigió y supervisó el proceso y realizó la implementación instrumental.
La encuesta (62 ítems formulados como una aseveración [afirmativa/negativa] recogiendo un criterio profesional) contenía 5 bloques: 1) aspectos nutricionales y digestivos (25 ítems: 7 Generales, 3 Grasas, 3 Hidratos de carbono, 7 Proteínas y 5 Fórmulas digestivas); 2) sistema inmune, desarrollo cerebral y retina (9 ítems); 3) salud ósea (12 ítems: 4 Vitamina D y 8 Calcio); 4) prebióticos (7 ítems), y 5) probióticos (9 ítems).
Los ítems se valoraron mediante una escala ordinal tipo Likert de 9 puntos.
El trabajo se desarrolló entre julio y septiembre de 2013.
Para analizar la opinión grupal y el consenso alcanzado se empleó la mediana de puntuaciones y el nivel de concordancia alcanzado7. Los ítems se consideraron consensuados cuando existió concordancia: los encuestados que puntuaron fuera de la región de 3 puntos ([1-3]-[4-6]-[7-9]) en la que se encontraba la mediana era menor de la tercera parte. En tal caso, el valor de la mediana determinó el consenso grupal: desacuerdo si la mediana era≤3, o acuerdo si la mediana era≥7. Los ítems en los que el valor de la mediana se encontraba en la región [4-6] se consideraron dudosos.
Se estableció discordancia cuando las puntuaciones de un tercio o más de los encuestados estaban en la región [1-3], y de otro tercio o más en la región [7-9].
Los ítems en los que no se observó concordancia ni discordancia se consideraron indeterminados.
Los ítems sin consenso (dudosos, con discordancia o consenso indeterminado) se reconsideraron en la segunda ronda, junto con aquellos con alta dispersión y rango intercuartílico≥4 puntos (rango de puntuaciones entre los valores p25 y p75 de la distribución).
Los resultados de la segunda ronda fueron analizados siguiendo los mismos criterios.
Para comparar gráficamente los ítems, se calculó el promedio de puntuación de los encuestados con su intervalo de confianza al 95%. Cuanto más próximo a 1 o 9 fuera el promedio de un ítem, mayor fue el consenso en acuerdo o en desacuerdo, respectivamente.
Un intervalo de confianza menor se interpretó como una mayor unanimidad. Los ítems sin consenso se analizaron de forma descriptiva para distinguir si la razón era la persistencia de la discordancia de criterio o el posicionamiento mayoritario del panel en la región de duda respecto al ítem (la mayoría del grupo sin criterio definitivo; región [4-6]).
El resultado de cada ítem se presenta indicándose la media, la mediana, el porcentaje de distribución de encuestados fuera de la región de la mediana, el rango intercuartílico y el resultado del consenso (tablas 1–5).
Resultados obtenidos del Bloque 1: Aspectos nutricionales y digestivos
| Ítems | Media | Mediana | Porcentaje fuera de la mediana | Rango intercuartílico | Resultado |
|---|---|---|---|---|---|
| General | |||||
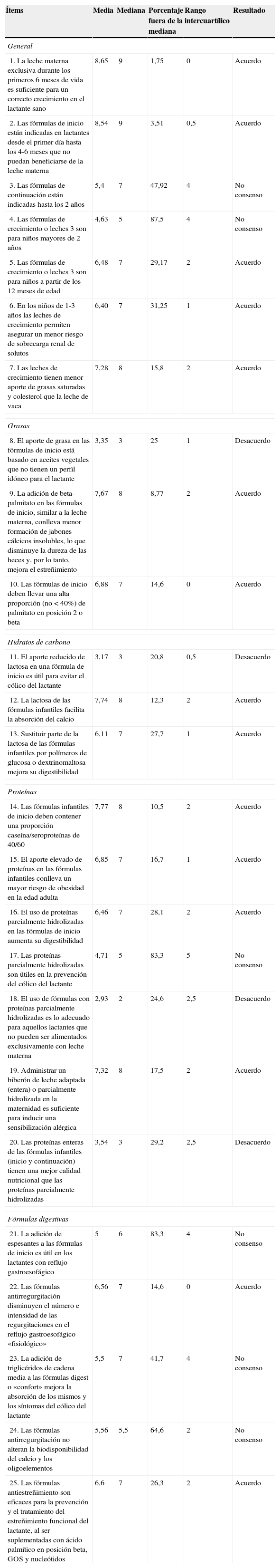
| 1. La leche materna exclusiva durante los primeros 6 meses de vida es suficiente para un correcto crecimiento en el lactante sano | 8,65 | 9 | 1,75 | 0 | Acuerdo |
| 2. Las fórmulas de inicio están indicadas en lactantes desde el primer día hasta los 4-6 meses que no puedan beneficiarse de la leche materna | 8,54 | 9 | 3,51 | 0,5 | Acuerdo |
| 3. Las fórmulas de continuación están indicadas hasta los 2 años | 5,4 | 7 | 47,92 | 4 | No consenso |
| 4. Las fórmulas de crecimiento o leches 3 son para niños mayores de 2 años | 4,63 | 5 | 87,5 | 4 | No consenso |
| 5. Las fórmulas de crecimiento o leches 3 son para niños a partir de los 12 meses de edad | 6,48 | 7 | 29,17 | 2 | Acuerdo |
| 6. En los niños de 1-3 años las leches de crecimiento permiten asegurar un menor riesgo de sobrecarga renal de solutos | 6,40 | 7 | 31,25 | 1 | Acuerdo |
| 7. Las leches de crecimiento tienen menor aporte de grasas saturadas y colesterol que la leche de vaca | 7,28 | 8 | 15,8 | 2 | Acuerdo |
| Grasas | |||||
| 8. El aporte de grasa en las fórmulas de inicio está basado en aceites vegetales que no tienen un perfil idóneo para el lactante | 3,35 | 3 | 25 | 1 | Desacuerdo |
| 9. La adición de beta-palmitato en las fórmulas de inicio, similar a la leche materna, conlleva menor formación de jabones cálcicos insolubles, lo que disminuye la dureza de las heces y, por lo tanto, mejora el estreñimiento | 7,67 | 8 | 8,77 | 2 | Acuerdo |
| 10. Las fórmulas de inicio deben llevar una alta proporción (no<40%) de palmitato en posición 2 o beta | 6,88 | 7 | 14,6 | 0 | Acuerdo |
| Hidratos de carbono | |||||
| 11. El aporte reducido de lactosa en una fórmula de inicio es útil para evitar el cólico del lactante | 3,17 | 3 | 20,8 | 0,5 | Desacuerdo |
| 12. La lactosa de las fórmulas infantiles facilita la absorción del calcio | 7,74 | 8 | 12,3 | 2 | Acuerdo |
| 13. Sustituir parte de la lactosa de las fórmulas infantiles por polímeros de glucosa o dextrinomaltosa mejora su digestibilidad | 6,11 | 7 | 27,7 | 1 | Acuerdo |
| Proteínas | |||||
| 14. Las fórmulas infantiles de inicio deben contener una proporción caseína/seroproteínas de 40/60 | 7,77 | 8 | 10,5 | 2 | Acuerdo |
| 15. El aporte elevado de proteínas en las fórmulas infantiles conlleva un mayor riesgo de obesidad en la edad adulta | 6,85 | 7 | 16,7 | 1 | Acuerdo |
| 16. El uso de proteínas parcialmente hidrolizadas en las fórmulas de inicio aumenta su digestibilidad | 6,46 | 7 | 28,1 | 2 | Acuerdo |
| 17. Las proteínas parcialmente hidrolizadas son útiles en la prevención del cólico del lactante | 4,71 | 5 | 83,3 | 5 | No consenso |
| 18. El uso de fórmulas con proteínas parcialmente hidrolizadas es lo adecuado para aquellos lactantes que no pueden ser alimentados exclusivamente con leche materna | 2,93 | 2 | 24,6 | 2,5 | Desacuerdo |
| 19. Administrar un biberón de leche adaptada (entera) o parcialmente hidrolizada en la maternidad es suficiente para inducir una sensibilización alérgica | 7,32 | 8 | 17,5 | 2 | Acuerdo |
| 20. Las proteínas enteras de las fórmulas infantiles (inicio y continuación) tienen una mejor calidad nutricional que las proteínas parcialmente hidrolizadas | 3,54 | 3 | 29,2 | 2,5 | Desacuerdo |
| Fórmulas digestivas | |||||
| 21. La adición de espesantes a las fórmulas de inicio es útil en los lactantes con reflujo gastroesofágico | 5 | 6 | 83,3 | 4 | No consenso |
| 22. Las fórmulas antirregurgitación disminuyen el número e intensidad de las regurgitaciones en el reflujo gastroesofágico «fisiológico» | 6,56 | 7 | 14,6 | 0 | Acuerdo |
| 23. La adición de triglicéridos de cadena media a las fórmulas digest o «confort» mejora la absorción de los mismos y los síntomas del cólico del lactante | 5,5 | 7 | 41,7 | 4 | No consenso |
| 24. Las fórmulas antirregurgitación no alteran la biodisponibilidad del calcio y los oligoelementos | 5,56 | 5,5 | 64,6 | 2 | No consenso |
| 25. Las fórmulas antiestreñimiento son eficaces para la prevención y el tratamiento del estreñimiento funcional del lactante, al ser suplementadas con ácido palmítico en posición beta, GOS y nucleótidos | 6,6 | 7 | 26,3 | 2 | Acuerdo |
GOS: galactooligosácaridos.
Resultados obtenidos del Bloque 2: Sistema inmune, desarrollo cerebral y retina
| Ítems | Media | Mediana | Porcentaje fuera de la mediana | Rango intercuartílico | Resultado |
|---|---|---|---|---|---|
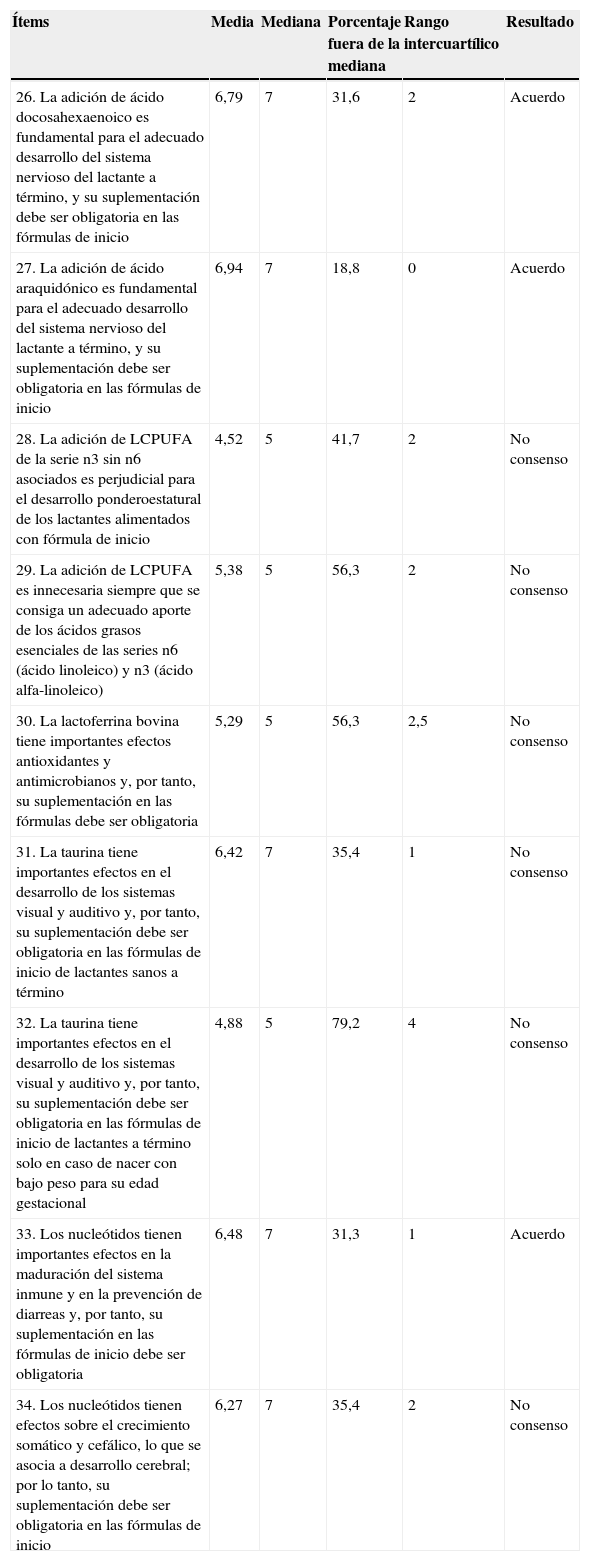
| 26. La adición de ácido docosahexaenoico es fundamental para el adecuado desarrollo del sistema nervioso del lactante a término, y su suplementación debe ser obligatoria en las fórmulas de inicio | 6,79 | 7 | 31,6 | 2 | Acuerdo |
| 27. La adición de ácido araquidónico es fundamental para el adecuado desarrollo del sistema nervioso del lactante a término, y su suplementación debe ser obligatoria en las fórmulas de inicio | 6,94 | 7 | 18,8 | 0 | Acuerdo |
| 28. La adición de LCPUFA de la serie n3 sin n6 asociados es perjudicial para el desarrollo ponderoestatural de los lactantes alimentados con fórmula de inicio | 4,52 | 5 | 41,7 | 2 | No consenso |
| 29. La adición de LCPUFA es innecesaria siempre que se consiga un adecuado aporte de los ácidos grasos esenciales de las series n6 (ácido linoleico) y n3 (ácido alfa-linoleico) | 5,38 | 5 | 56,3 | 2 | No consenso |
| 30. La lactoferrina bovina tiene importantes efectos antioxidantes y antimicrobianos y, por tanto, su suplementación en las fórmulas debe ser obligatoria | 5,29 | 5 | 56,3 | 2,5 | No consenso |
| 31. La taurina tiene importantes efectos en el desarrollo de los sistemas visual y auditivo y, por tanto, su suplementación debe ser obligatoria en las fórmulas de inicio de lactantes sanos a término | 6,42 | 7 | 35,4 | 1 | No consenso |
| 32. La taurina tiene importantes efectos en el desarrollo de los sistemas visual y auditivo y, por tanto, su suplementación debe ser obligatoria en las fórmulas de inicio de lactantes a término solo en caso de nacer con bajo peso para su edad gestacional | 4,88 | 5 | 79,2 | 4 | No consenso |
| 33. Los nucleótidos tienen importantes efectos en la maduración del sistema inmune y en la prevención de diarreas y, por tanto, su suplementación en las fórmulas de inicio debe ser obligatoria | 6,48 | 7 | 31,3 | 1 | Acuerdo |
| 34. Los nucleótidos tienen efectos sobre el crecimiento somático y cefálico, lo que se asocia a desarrollo cerebral; por lo tanto, su suplementación debe ser obligatoria en las fórmulas de inicio | 6,27 | 7 | 35,4 | 2 | No consenso |
LCPUFA: ácidos grasos poliinsaturados de cadena larga.
Resultados obtenidos del Bloque 3: Salud ósea
| Ítems | Media | Mediana | Porcentaje fuera de la mediana | Rango intercuartílico | Resultado |
|---|---|---|---|---|---|
| Vitamina D | |||||
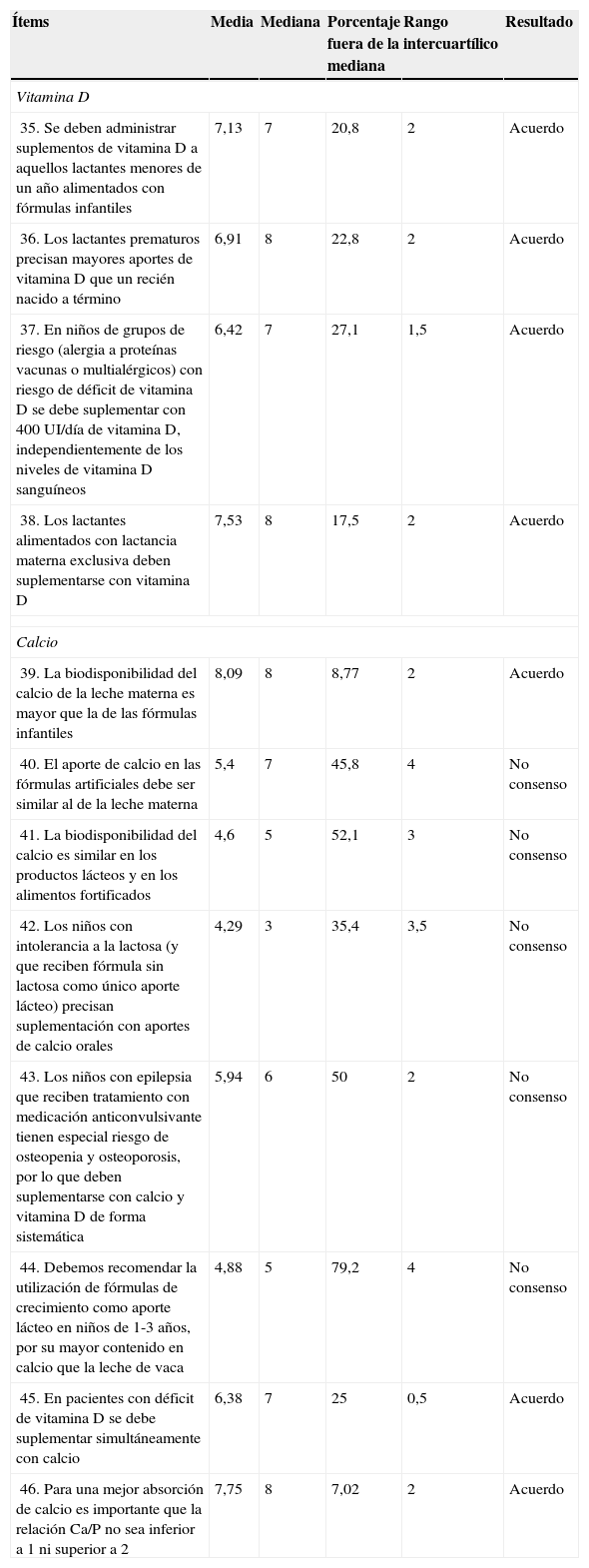
| 35. Se deben administrar suplementos de vitamina D a aquellos lactantes menores de un año alimentados con fórmulas infantiles | 7,13 | 7 | 20,8 | 2 | Acuerdo |
| 36. Los lactantes prematuros precisan mayores aportes de vitamina D que un recién nacido a término | 6,91 | 8 | 22,8 | 2 | Acuerdo |
| 37. En niños de grupos de riesgo (alergia a proteínas vacunas o multialérgicos) con riesgo de déficit de vitamina D se debe suplementar con 400UI/día de vitamina D, independientemente de los niveles de vitamina D sanguíneos | 6,42 | 7 | 27,1 | 1,5 | Acuerdo |
| 38. Los lactantes alimentados con lactancia materna exclusiva deben suplementarse con vitamina D | 7,53 | 8 | 17,5 | 2 | Acuerdo |
| Calcio | |||||
| 39. La biodisponibilidad del calcio de la leche materna es mayor que la de las fórmulas infantiles | 8,09 | 8 | 8,77 | 2 | Acuerdo |
| 40. El aporte de calcio en las fórmulas artificiales debe ser similar al de la leche materna | 5,4 | 7 | 45,8 | 4 | No consenso |
| 41. La biodisponibilidad del calcio es similar en los productos lácteos y en los alimentos fortificados | 4,6 | 5 | 52,1 | 3 | No consenso |
| 42. Los niños con intolerancia a la lactosa (y que reciben fórmula sin lactosa como único aporte lácteo) precisan suplementación con aportes de calcio orales | 4,29 | 3 | 35,4 | 3,5 | No consenso |
| 43. Los niños con epilepsia que reciben tratamiento con medicación anticonvulsivante tienen especial riesgo de osteopenia y osteoporosis, por lo que deben suplementarse con calcio y vitamina D de forma sistemática | 5,94 | 6 | 50 | 2 | No consenso |
| 44. Debemos recomendar la utilización de fórmulas de crecimiento como aporte lácteo en niños de 1-3 años, por su mayor contenido en calcio que la leche de vaca | 4,88 | 5 | 79,2 | 4 | No consenso |
| 45. En pacientes con déficit de vitamina D se debe suplementar simultáneamente con calcio | 6,38 | 7 | 25 | 0,5 | Acuerdo |
| 46. Para una mejor absorción de calcio es importante que la relación Ca/P no sea inferior a 1 ni superior a 2 | 7,75 | 8 | 7,02 | 2 | Acuerdo |
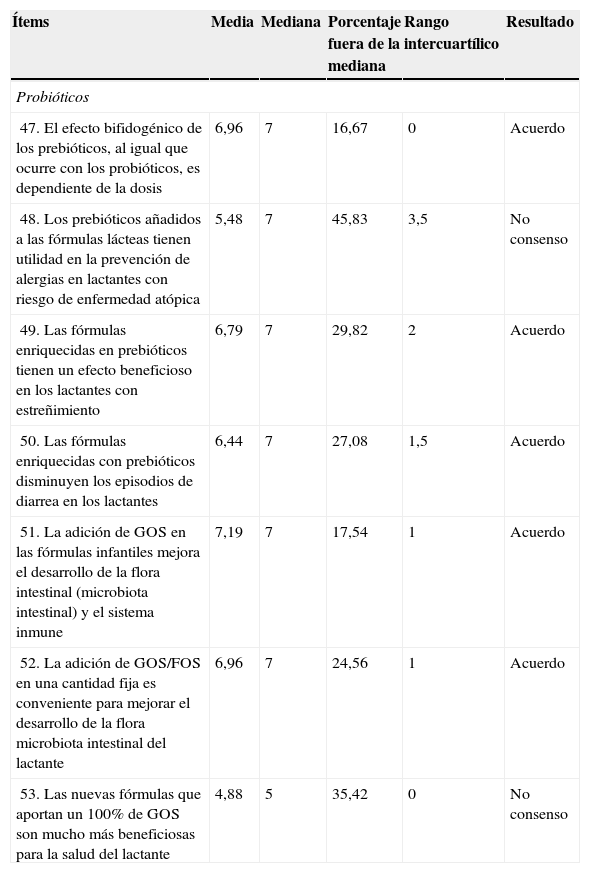
Resultados obtenidos del Bloque 4: Prebióticos
| Ítems | Media | Mediana | Porcentaje fuera de la mediana | Rango intercuartílico | Resultado |
|---|---|---|---|---|---|
| Probióticos | |||||
| 47. El efecto bifidogénico de los prebióticos, al igual que ocurre con los probióticos, es dependiente de la dosis | 6,96 | 7 | 16,67 | 0 | Acuerdo |
| 48. Los prebióticos añadidos a las fórmulas lácteas tienen utilidad en la prevención de alergias en lactantes con riesgo de enfermedad atópica | 5,48 | 7 | 45,83 | 3,5 | No consenso |
| 49. Las fórmulas enriquecidas en prebióticos tienen un efecto beneficioso en los lactantes con estreñimiento | 6,79 | 7 | 29,82 | 2 | Acuerdo |
| 50. Las fórmulas enriquecidas con prebióticos disminuyen los episodios de diarrea en los lactantes | 6,44 | 7 | 27,08 | 1,5 | Acuerdo |
| 51. La adición de GOS en las fórmulas infantiles mejora el desarrollo de la flora intestinal (microbiota intestinal) y el sistema inmune | 7,19 | 7 | 17,54 | 1 | Acuerdo |
| 52. La adición de GOS/FOS en una cantidad fija es conveniente para mejorar el desarrollo de la flora microbiota intestinal del lactante | 6,96 | 7 | 24,56 | 1 | Acuerdo |
| 53. Las nuevas fórmulas que aportan un 100% de GOS son mucho más beneficiosas para la salud del lactante | 4,88 | 5 | 35,42 | 0 | No consenso |
FOS: fructooligosacáridos; GOS: galactooligosácaridos.
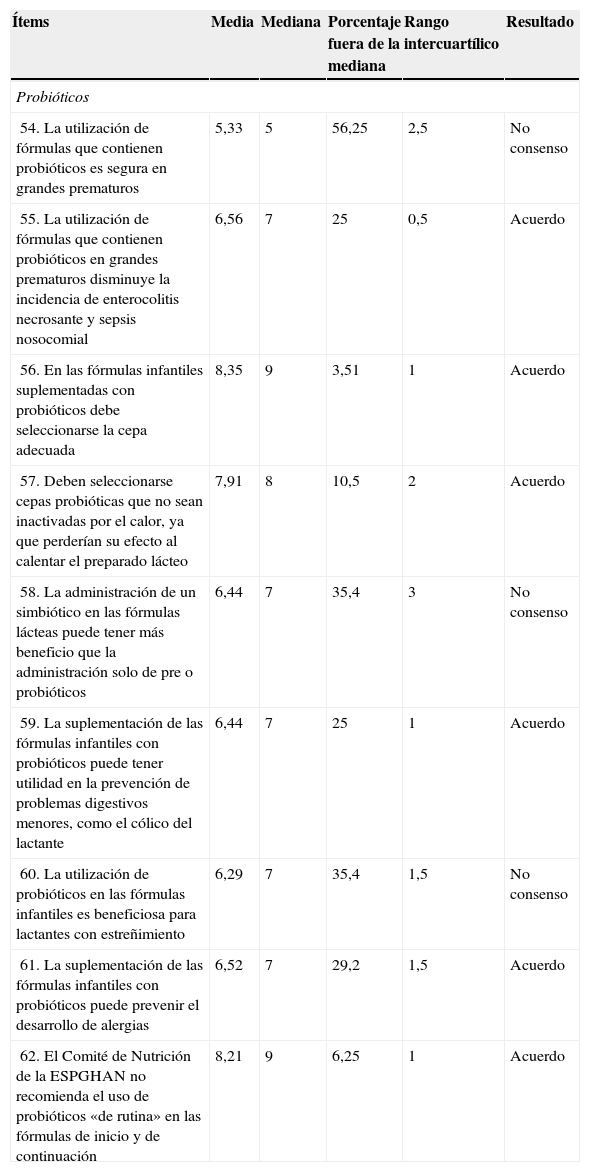
Resultados obtenidos del Bloque 5: Probióticos
| Ítems | Media | Mediana | Porcentaje fuera de la mediana | Rango intercuartílico | Resultado |
|---|---|---|---|---|---|
| Probióticos | |||||
| 54. La utilización de fórmulas que contienen probióticos es segura en grandes prematuros | 5,33 | 5 | 56,25 | 2,5 | No consenso |
| 55. La utilización de fórmulas que contienen probióticos en grandes prematuros disminuye la incidencia de enterocolitis necrosante y sepsis nosocomial | 6,56 | 7 | 25 | 0,5 | Acuerdo |
| 56. En las fórmulas infantiles suplementadas con probióticos debe seleccionarse la cepa adecuada | 8,35 | 9 | 3,51 | 1 | Acuerdo |
| 57. Deben seleccionarse cepas probióticas que no sean inactivadas por el calor, ya que perderían su efecto al calentar el preparado lácteo | 7,91 | 8 | 10,5 | 2 | Acuerdo |
| 58. La administración de un simbiótico en las fórmulas lácteas puede tener más beneficio que la administración solo de pre o probióticos | 6,44 | 7 | 35,4 | 3 | No consenso |
| 59. La suplementación de las fórmulas infantiles con probióticos puede tener utilidad en la prevención de problemas digestivos menores, como el cólico del lactante | 6,44 | 7 | 25 | 1 | Acuerdo |
| 60. La utilización de probióticos en las fórmulas infantiles es beneficiosa para lactantes con estreñimiento | 6,29 | 7 | 35,4 | 1,5 | No consenso |
| 61. La suplementación de las fórmulas infantiles con probióticos puede prevenir el desarrollo de alergias | 6,52 | 7 | 29,2 | 1,5 | Acuerdo |
| 62. El Comité de Nutrición de la ESPGHAN no recomienda el uso de probióticos «de rutina» en las fórmulas de inicio y de continuación | 8,21 | 9 | 6,25 | 1 | Acuerdo |
ESPGHAN: European Society for Paediatric Gastroenterology, Hepatology and Nutrition.
Para justificar los resultados sobre los aspectos evaluados en los ítems, tanto consensuados como no, se realizó una búsqueda bibliográfica, empleando, entre otras herramientas, la plataforma bibliográfica PubMed. El objetivo era identificar lo publicado respecto a lo expuesto en cada ítem (práctica clínica, investigación, etc.).
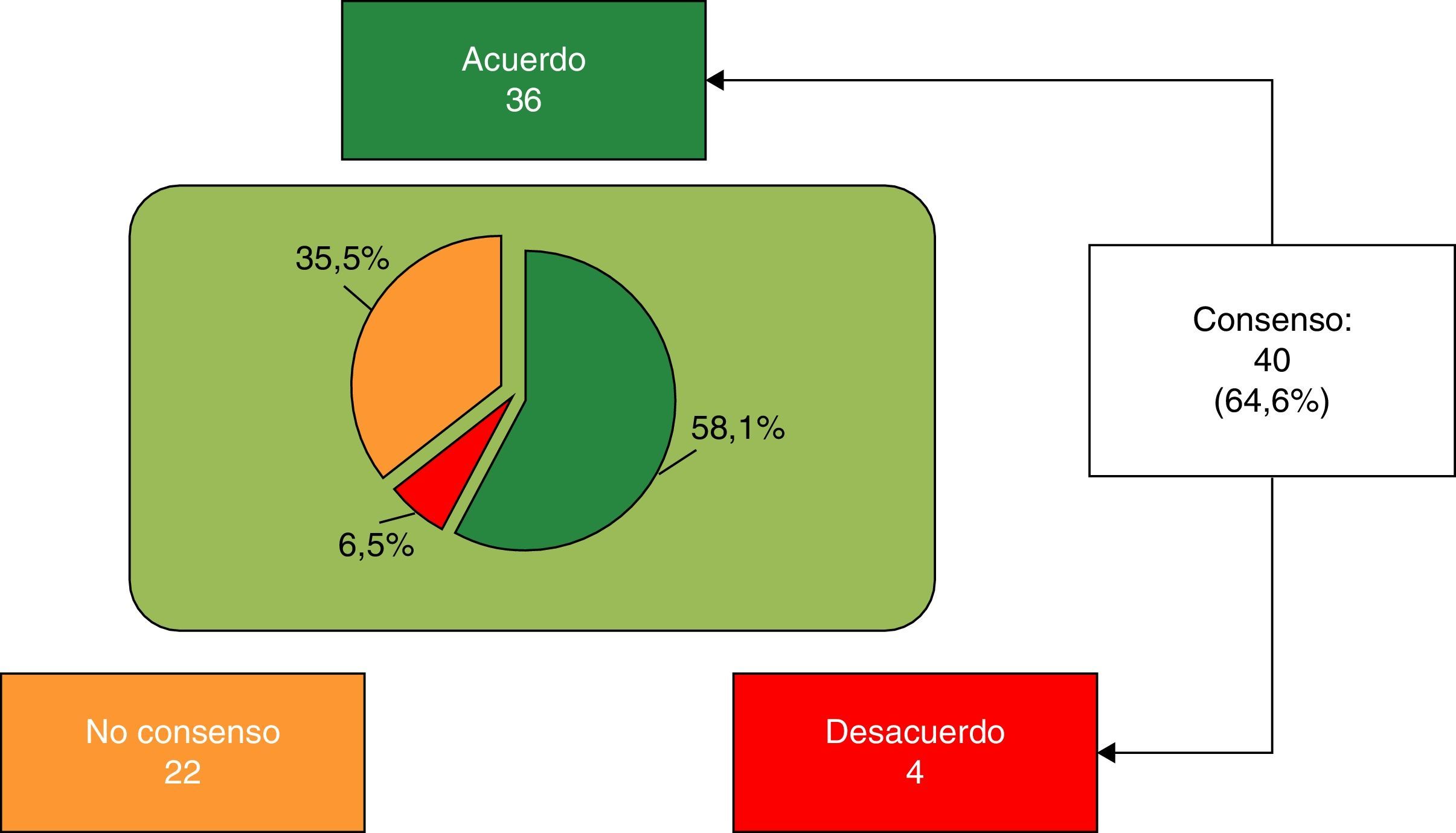
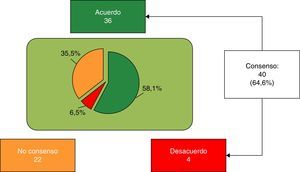
ResultadosEn la primera ronda se consensuaron 20 de 62 ítems. Aquellos sin consensuar (Bloque 1: 3-6, 8, 10, 11, 13, 15, 17 y 20-24; Bloque 2: 27-34; Bloque 3: 35, 37, 40-45; Bloque 4: 47, 48, 50, 53; Bloque 5: 55 y 58-62) fueron propuestos a reconsideración en la segunda ronda, consensuándose 20. Los 22 (35,4%) no consensuados fueron: Bloque 1: 3, 4, 17, 21, 23 y 24; Bloque 2: 28-32 y 34; Bloque 3: 40-44; Bloque 4: 48 y 53; Bloque 5: 54, 58 y 60.
Finalmente, se consensuaron 40 de 62 ítems (64,6%), 36 (58,1%) de acuerdo con la aseveración, y los 4 restantes (6,5%), de rechazo (fig. 1). Bloque 1, Aspectos nutricionales y digestivos: se consensuaron 19 de 25 ítems (5 del subapartado General, 6 del subapartado Grasas y 9 del subapartado Proteínas), 15 en términos de acuerdo y 4 en desacuerdo. Los 6 ítems restantes no se consensuaron (tabla 1). Bloque 2, Sistema inmune, desarrollo cerebral y retina: se consensuaron 3 de 9 ítems, todos con acuerdo; los 6 restantes no fueron consensuados (tabla 2). Bloque 3, Salud ósea: se consensuaron 7 de 12 ítems (4 del subapartado Vitamina D y 3 del subapartado Calcio) (tabla 3); los 5 restantes no se consensuaron. Bloque 4, Prebióticos: se consensuaron 5 de 7 ítems, todos con acuerdo; los otros 2 ítems no se consensuaron (tabla 4). Bloque 5, Probióticos: se consensuaron 6 de 9 ítems en términos de acuerdo, no consensuándose los 3 restantes (tabla 5).
DiscusiónLa opinión manifestada por los expertos en nutrición y gastroenterología infantil refleja que el criterio profesional sobre fórmulas infantiles no está del todo unificado. Se consensuaron el 65% de los aspectos presentados.
Coincidiendo con lo publicado2,8, se consensuó que la leche materna permite un adecuado crecimiento del lactante sano durante los 6 primeros meses de vida. En el caso de que esta no sea posible, hubo consenso respecto a la idoneidad de las fórmulas de inicio hasta los 4-6 meses, momento del paso paulatino a una alimentación diversificada9. Sobre la edad indicada para la administración de leches de continuación no hubo acuerdo, probablemente por las diferentes composiciones requeridas según la etapa del desarrollo10. Sin embargo, para los preparados de crecimiento (fórmulas de continuación modificadas)11 se consensuó su idoneidad a partir del año de edad, reflejando un conocimiento de sus características nutricionales (perfil lipídico adecuado)11 y la falta de legislación al respecto.
En cuanto al aporte proteico de las fórmulas infantiles, se mostró desacuerdo sobre la mejor calidad nutricional de las proteínas enteras respecto a las parcialmente hidrolizadas; sin embargo, no se consensuó la adecuación de estas últimas en lactantes no alimentados con leche materna. La proporción caseína/seroproteínas 40/60, que consigue un aporte de aminoácidos similar al de la leche materna9, fue considerada adecuada. También se acordó que el aporte proteico elevado incrementa el riesgo de obesidad, mostrando un conocimiento sobre el tema, ya descrito12.
No se obtuvo consenso respecto al papel de las proteínas parcialmente hidrolizadas y la reducción de lactosa en las fórmulas para prevenir el cólico del lactante. El cólico se valora mediante el tiempo de llanto del bebé; añadir caseína hidrolizada a la fórmula infantil no aporta evidencias suficientes en la reducción del mismo13, tampoco las fórmulas bajas en lactosa13 ni la suplementación de triglicéridos de cadena media14.
Sobre la aparición de alergias, los panelistas manifestaron acuerdo en que no hay diferencias entre fórmulas con proteínas enteras o parcialmente hidrolizadas. Está en debate el papel de las proteínas en la prevención de alergias15.
No existió consenso respecto a los espesantes añadidos a las fórmulas de inicio en el reflujo gastroesofágico del lactante, aunque se acordó que disminuyen el número e intensidad de las regurgitaciones fisiológicas. Los espesantes, aunque disminuyen los episodios de regurgitación, son moderadamente efectivos en lactantes sanos16, por ello no se deben indicar rutinariamente en estos. No se consensuó que las fórmulas antirregurgitación alterasen la biodisponibilidad del calcio y de oligoelementos, aunque Horvath et al. demostraron que los espesantes pueden alterar la absorción de calcio, otros iones e hidratos de carbono16.
Existe acuerdo respecto a que la biodisponibilidad del calcio es mayor en la leche materna frente a las fórmulas infantiles17, pero no en cuanto al contenido apropiado de calcio en estas últimas. Esta discrepancia podría explicarse por el hecho de que las mayores concentraciones de calcio en las fórmulas infantiles se relacionan con una peor absorción y biodisponibilidad del calcio; en fórmulas con concentraciones de calcio de 389, 659 y 1.024mg/L, la fracción de absorción es del 57, 47 y 37%, respectivamente17. Está establecido que la proporción de Ca/P no debe ser ni inferior a 1 ni superior a 28.
También hubo acuerdo respecto a que la adición de lactosa facilita la absorción de calcio y el desarrollo de la microflora bacteriana18. Sin embargo, el aumento de casos de intolerancia a la lactosa justifica el acuerdo de sustituir parte de la lactosa por glucosa/dextrinomaltosa para mejorar la digestibilidad. En fórmulas sin lactosa se ha demostrado que aun siendo la absorción de calcio inferior a la de aquellas con lactosa, es suficiente para satisfacer las necesidades de los lactantes17, siempre y cuando las cantidades ingeridas cumplan las recomendaciones de ingesta diarias. Aun así no se consensuó si los lactantes alimentados con fórmulas sin lactosa precisan suplementación con calcio porque sigue siendo un tema controvertido.
Hubo acuerdo respecto a la necesidad de suplementación con vitamina D en los menores de un año. Igualmente, en que los prematuros tienen mayor riesgo de déficit de vitamina D debido al menor volumen de leche que ingieren y a la presencia de bajos niveles de dicha vitamina al nacer. Hay estudios que indican que no precisan mayor aporte de vitamina D que los no prematuros19; dosis altas de esta vitamina no consiguen mejores efectos sobre la mineralización ósea, por lo que se aconseja administrar un aporte de 400UI/día al igual que en los demás recién nacidos20. El consenso puede estar en relación con el conocimiento sobre las recomendaciones de ingesta de vitamina D (según el Comité de Nutrición de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition y la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica).
No se alcanzó consenso en la suplementación con calcio y vitamina D de forma sistemática en niños epilépticos con medicación anticonvulsivante. Parece que los gastroenterólogos pediátricos están concienciados del riesgo de alteraciones del metabolismo calcio-fósforo en estos pacientes (en relación con la medicación anticonvulsivante, inmovilización). No ocurre lo mismo con la mayoría de los neurólogos pediatras que no evalúan rutinariamente la salud ósea21. Aunque algunos recomiendan esta suplementación para mejorar la estructura ósea y la calidad de vida22, otros consideran que este aporte debe ir evaluándose en conjunto con otros factores (aporte nutricional y exposición solar)23.
Se consensuó que la adición de beta-palmitato y su adecuada proporción reduce la formación de jabones cálcicos insolubles y mejora el estreñimiento. El beta-palmitato, en las diferentes fórmulas, simula la leche materna aumentando la absorción de ácidos grasos y calcio24, además de beneficiar la microflora bacteriana25. Respecto al aminoácido taurina, no se logró consenso sobre su implementación, a pesar de relacionarse con desarrollo neuronal y diferenciación-migración celular en el cerebelo y el córtex visual26. Ni en lactantes a término sanos ni con poco peso se alcanzó la obligatoriedad de añadir taurina. Un metaanálisis no mostró diferencias estadísticas en el crecimiento en lactantes suplementados con/sin taurina27. La suplementación obligatoria con lactoferrina bovina tampoco se consensuó; a pesar de los beneficios descritos en la población infantil (enfermedades respiratorias y niveles de hematocrito), son necesarios más estudios para corroborar estos efectos28.
Respecto a la suplementación con ácidos grasos poliinsaturados de cadena larga (LCPUFA), los expertos expresaron la idoneidad de añadir ácido docosahexaenoico y ácido araquidónico (LCPUFA n3 y n6, respectivamente) para el desarrollo del sistema nervioso. La presencia de ácido araquidónico y ácido docosahexaenoico en las fórmulas para lactantes29 en igual proporción que en la leche materna ha demostrado ser relevante y segura para conseguir un adecuado desarrollo cognitivo30. Los panelistas no consensuaron un efecto perjudicial de la adición de LCPUFA de serie n3 (sin n6 asociados) en el desarrollo ponderoestatural. Tampoco se alcanzó acuerdo sobre la necesidad de añadir otros LCPUFA en las fórmulas que contienen únicamente ácidos grasos esenciales: linoleico y alfa-linoleico.
En el caso de la suplementación de las fórmulas de inicio con nucleótidos, en concordancia con lo publicado, se consensuó su obligatoriedad por sus efectos en la maduración del sistema inmune y en la prevención de diarreas, esto último en beneficio del crecimiento31. Sin embargo, no se alcanzó acuerdo sobre su implicación en el desarrollo cerebral.
En cuanto al papel de los prebióticos en las fórmulas infantiles, hubo consenso respecto a su efecto dependiente de la dosis32 y a que su administración aumenta el número de bifidobacterias en heces, con efecto positivo sobre la consistencia de estas. Las fórmulas lácteas con prebióticos pueden tener un efecto beneficioso en lactantes con estreñimiento, disminuyendo los episodios de diarrea33 y previniendo alergias34. Es necesaria más investigación antes de utilizarlos rutinariamente para prevenir alergias35.
La adición de GOS en las fórmulas infantiles mejora la flora intestinal36 y el sistema inmune32. La adición de GOS/FOS en una cantidad fija es conveniente para mejorar el desarrollo de la microbiota intestinal. La Directiva de la Comisión Europea relativa a preparados para lactantes y de continuación (Directiva 141/2006, de 22 de diciembre de 2006) confirma que pueden añadirse FOS y GOS a los preparados, en cantidad no superior a 0,8g/100ml según la combinación de 90% oligogalactosil lactosa y 10% oligosil sacarosa de elevado peso molecular32.
A pesar de las evidencias de que los probióticos pueden utilizarse con seguridad en prematuros, según el Comité de Nutrición de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (2011)4 y la revisión Cochrane de 201137, demostrando su utilidad previniendo la enterocolitis necrosante en grandes prematuros, existe preocupación por su seguridad y sus efectos a largo plazo. Esto podría explicar la falta de consenso respecto a este punto.
Existe una falta de consenso en relación con el beneficio de la administración de un simbiótico frente a pre o probióticos, aunque los simbióticos aportarían más beneficios de su unión38. No hay suficientes estudios que demuestren este beneficio. De ahí que no exista acuerdo entre los panelistas.
Varios estudios han demostrado el beneficio de los probióticos en el tratamiento de los cólicos, pero no hay apenas estudios al respecto con probióticos en las fórmulas39. La mayoría de los encuestados están de acuerdo en la utilidad de los probióticos en el cólico, lo que puede indicar que se ha extrapolado el beneficio demostrado de la utilización directa de probióticos a su suplementación en leches infantiles. Así L. reuteri ha mostrado cierto beneficio como tratamiento del cólico en lactantes alimentados exclusivamente con leche materna, pero el beneficio no parece tan claro si están alimentados con fórmula40. No hay un beneficio demostrado de su uso en la prevención de alergias cuando se administran de forma independiente.
En conclusión, los resultados de este estudio manifiestan el acuerdo de los especialistas sobre la idoneidad de la leche materna para el adecuado crecimiento del lactante, y la de las fórmulas de inicio hasta los 4-6 meses, en caso de no ser posible la leche materna. La edad adecuada para el inicio de las fórmulas de crecimiento se estableció en un año, quedando sin determinar la edad adecuada del inicio para las leches de continuación. Se consensuó el perfil lipídico adecuado de las fórmulas infantiles mediante el aporte de grasas vegetales y beta-palmitato, además del efecto beneficioso en el estado gastrointestinal del lactante. Sin embargo, no se consensuó la calidad nutricional de las proteínas enteras vs. parcialmente hidrolizadas, ambas consideradas implicadas en la inducción de alergias, ni que los espesantes modifiquen la biodisponibilidad de calcio y otros oligoelementos. Respecto a la lactosa, debido al aumento de casos de intolerancia, los especialistas consideraron apropiado el sustituir parte de esta por glucosa o dextrinomaltosa para mejorar la digestibilidad, a pesar de su capacidad para favorecer la absorción de calcio. También se manifestó el acuerdo sobre la incorporación de ácido docosahexaenoico y ácido araquidónico, con nucleótidos por sus efectos en la maduración del sistema inmune; y suplementación con vitamina D (400UI/día) para todos los lactantes, sin consensuarse esta última en niños epilépticos. Sin embargo, no se alcanzó consenso sobre la suplementación con taurina y lactoferrina. La suplementación con prebióticos y GOS/GOF se acordó recomendable por sus efectos beneficiosos sobre el estreñimiento, las diarreas y su capacidad inmunomoduladora. Sin embargo, la falta de estudios sobre el beneficio de los probióticos y simbióticos justifica el que no se recomiende su uso y el consenso alcanzado sobre no recomendar su adición hasta que no haya más estudios que demuestren su eficacia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Josefa Barrio Torres.
Juan José Díaz Martín.
Ignacio Manrique Martínez.
Benjamín Martín Martínez.
Eduardo Ortega Páez.
- 1.
Guillermo Álvarez Calatayud.
- 2.
M. Luisa Arroba Basanta.
- 3.
Alfonso Barrio Merino.
- 4.
Patricia Barros García.
- 5.
Luis Carlos Blesa Baviera.
- 6.
Carlos Bousoño García.
- 7.
M. Ángeles Calzado Agrasot.
- 8.
Alejandro Canals Baeza.
- 9.
Francisco Cañabate Reche.
- 10.
Margarita Cañellas Fuster.
- 11.
Esperanza Castejón Ponce.
- 12.
M. Teresa Cenarro Guerrero.
- 13.
Agustín de la Mano Hernández.
- 14.
Beatriz Espín Jaime.
- 15.
Gonzalo Galicia Poblet.
- 16.
Salvador García Calatayud.
- 17.
Carmen García Rebollar.
- 18.
Juan José Gilbert Pérez.
- 19.
M. Ángeles Gómez Ortigosa.
- 20.
Rafael González de Caldas Marchal.
- 21.
Iñaki Irastorza Terradillos.
- 22.
Ana Isabel Jiménez Moya.
- 23.
Carmen Jovaní Casano.
- 24.
M. José López Liñán.
- 25.
Óscar Manrique Moral.
- 26.
Manuel Martín González.
- 27.
Emilio Martín Orte.
- 28.
Eva Martínez-Ojinaga Nodal.
- 29.
M. Lluïsa Masiques Mas.
- 30.
Silvia M. Meavilla Olivas.
- 31.
Antonio Millán Jiménez.
- 32.
Carmen Miranda Cid.
- 33.
Rosa Ana Muñoz Codoceo.
- 34.
Víctor Manuel Navas López.
- 35.
José M. Olivares Rossell.
- 36.
Luis Peña Quintana.
- 37.
Margarita Revenga Parra.
- 38.
M. del Carmen Rivero de la Rosa.
- 39.
Carmen Rodríguez López.
- 40.
Alejandro Rodríguez Martínez.
- 41.
Julio Romero González.
- 42.
Antonio Rosell Camps.
- 43.
César Sánchez Sánchez.
- 44.
Félix Sánchez-Valverde Visus.
- 45.
Alfonso Jesús Solar Boga.
- 46.
Pilar Valverde Viu.
- 47.
Florencia Inés Venturini-
- 48.
Isidro Vitoria Miñana.