El consentimiento informado del menor es un requerimiento fundamental de la investigación pediátrica. Actualmente existe una desarmonización en cuanto a la edad del menor maduro para consentir y no se dispone de herramientas sistemáticas para evaluar la competencia en la capacidad de decisión. El objetivo de este trabajo es analizar la situación ética y legal del consentimiento en menores, así como los estudios que utilizan un instrumento objetivo de evaluación en el menor maduro.
Material y métodosRevisión bibliográfica de artículos científicos en PubMed, Embase y Literatura gris, publicados con palabras clave «informed consent minors», sin restricción de fecha hasta marzo 2019. Se revisaron los abstracts y una selección de los artículos completos siguiendo un protocolo de identificación, cribado, elegibilidad e inclusión.
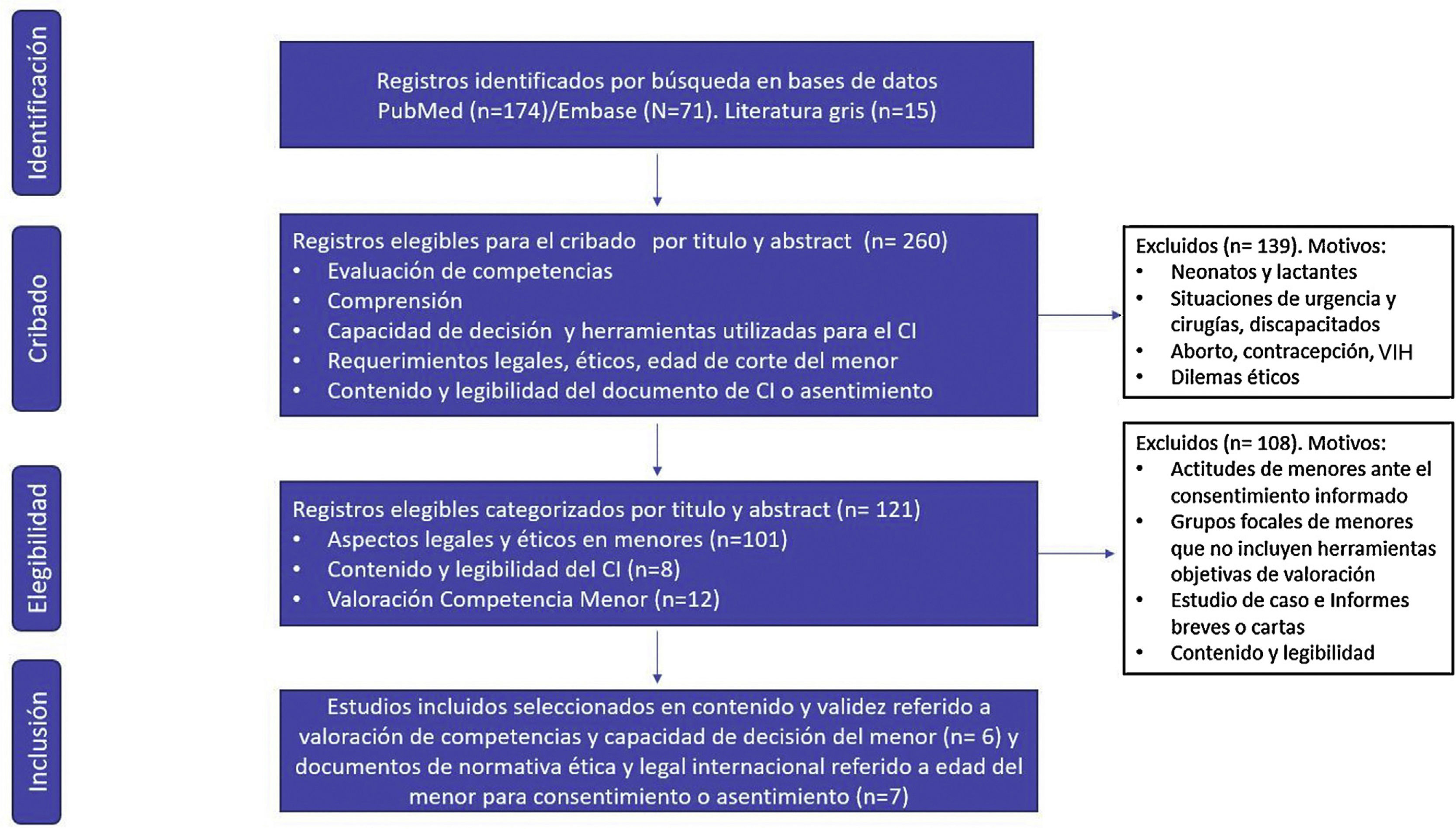
ResultadosDe los 260 registros identificados, se excluyeron 139. Tras categorizar los 121 artículos resultantes, finalmente se seleccionaron 13 siguiendo los criterios de elegibilidad, incluyéndose 7 artículos sobre normativa ética y legal internacional, y 6 sobre evaluación de comprensión y capacidad de decisión. En 4 estudios se ha utilizado la entrevista semiestructurada McCarthur Competency Assessment Tool for Clinical Research (MacCAT-CR), en diferentes rangos de edad (6-21 años), niños sanos y con alguna patología.
ConclusionesLa entrevista semiestructurada McCarthur adaptada a adolescentes podría ser una herramienta adecuada con medidas psicométricas robustas para la valoración de competencia para el consentimiento informado de menores entre 9 y 12 años. La regulación del consentimiento informado en investigación pediátrica debería ser receptiva a estas evidencias.
The informed consent of the minor is a fundamental requirement of paediatric research. There is a lack of harmonisation as regards the age of the mature minor to consent, and there are no systematic tools available to assess competence in decision-making capacity. The objective of this work is to analyse the ethical and legal situation of consent by minors, as well as studies that use an objective assessment tool in the mature minor.
Material and methodsSystematic review of scientific articles in PubMed, Embase and the Grey Literature, published with keywords “informed consent minors”, without date restriction until March 2019. Abstracts and a selection of complete articles were reviewed following a protocol including identification, screening, eligibility, and inclusion.
ResultsOf the 260 records identified, 139 were excluded. After categorising the resulting 121 publications, 13 were finally selected following the eligibility criteria, including 7 articles on international ethical and legal regulations and 6 on understanding and decision- making capacity assessment. The MacArthur Competence Assessment Tool for Clinical Research (MacCAT-CR) semi-structured interview was used in 4 studies, including different age ranges (6-21 years) in healthy and sick children.
ConclusionsThe semi-structured MacArthur interview adapted to adolescents could be an appropriate tool with robust psychometric measures for assessing competence for the informed consent of minors between 9 and 12 years of age. The regulation of informed consent in paediatric research should consider this evidence.
La investigación clínica en población pediátrica se ha incrementado significativamente en las últimas décadas y las autoridades sanitarias reconocen la necesidad de realizar mayor volumen de ensayos en esta población vulnerable e infrarrepresentada en los ensayos clínicos1,2. La prescripción de medicamentos en condiciones no autorizadas en su ficha técnica es frecuente, como es el caso de la hormona de crecimiento y otros fármacos utilizados en endocrinología pediátrica3,4.
Los niños presentan diferencias fisiológicas, psicológicas y evolutivas que requieren la realización de ensayos específicos con nuevos medicamentos y vacunas, para conocer la farmacodinamia, farmacocinética, perfil de seguridad y mejorar los tratamientos disponibles para ellos5. La investigación clínica en población pediátrica implica consideraciones éticas y legales únicas y complejas. La situación de vulnerabilidad, unida a la ausencia de capacidad legal para consentir del menor, exige la garantía de la protección de sus derechos y la minimización de los riesgos.
El consentimiento o asentimiento del menor es un requerimiento fundamental de la investigación pediátrica, así como en la toma de decisiones médicas, contemplado en los códigos éticos internacionales (Declaración de Helsinki 2013, Council for International Organizations of Medical Sciences, ICH-GCPs International Conference Harmonization-Good Clinical Practices, Nuffield council on Bioethics, 2015) y legislaciones nacionales aplicables.
Consentimiento y asentimiento difieren. El consentimiento es una decisión formalizada de otorgar permiso para participar en la investigación, realizada por un individuo adecuadamente informado y con capacidad legal para consentir. El asentimiento implica el mismo permiso, con la diferencia de que el individuo que lo presta carece de capacidad legal y se requiere el consentimiento de una persona legalmente capacitada (en el caso de un menor, los padres o representantes legales). Según la declaración de Helsinki: «Cuando un sujeto legalmente incompetente, como un menor, es capaz de otorgar su asentimiento para decisiones sobre participación en investigación, el investigador debe obtener ese asentimiento adicionalmente al consentimiento».
El proceso de consentimiento/asentimiento del menor conlleva retos importantes para los investigadores, entre ellos, la inteligibilidad de la hoja de información al paciente. Habitualmente se elaboran hojas de información no adaptadas al nivel de entendimiento de los potenciales participantes (tanto adultos como menores), lo que dificulta el proceso de comprensión y, por tanto, la capacidad para decidir6–8.
En menores, con independencia de la edad legal para consentir, pues cuando no la alcancen deberán asentir si están en condiciones para ello, resulta crucial proporcionar información adecuada a su nivel de comprensión, en un lenguaje, extensión y formato apropiado, así como verificar la comprensión de la información9. Es importante considerar las diferencias en su capacidad de decisión, inherentes no solo a la edad, sino a los grados de desarrollo psicoevolutivo, factores socioambientales y familiares, así como su condición médica10.
En general, a partir de los 7 años los niños desarrollan capacidad suficiente para comprender los procedimientos de la investigación y cómo puede diferir de la asistencia médica de rutina; por tanto, a partir de esta edad podrían asentir sobre su participación, sosteniéndose por algunos autores la conveniencia de personalizar el proceso, adaptándolo a cada niño en particular11–13.
Actualmente no hay una herramienta sistemática para evaluar la competencia del menor en la toma de decisión y existe una falta de consenso sobre la edad del menor para consentir tanto en investigación clínica como en decisiones de salud, quedando a juicio del investigador o clínico la valoración sobre la capacidad, madurez y comprensión del menor10.
El objetivo de este trabajo es analizar mediante una revisión bibliográfica: 1) la situación global ética y regulatoria actual del consentimiento informado (CI) en menores sobre decisiones de salud y/o en investigación clínica, y 2) los estudios que utilizan un instrumento objetivo de evaluación de la competencia del menor en el proceso de CI tanto en decisiones sanitarias como en protocolos de investigación
Material y métodosDiseño y criterios de elegibilidad: Se ha realizado una revisión de artículos científicos y literatura gris por parte de un solo revisor de acuerdo con el siguiente protocolo:
Fase de identificaciónCon las palabras clave «Informed consent, minors, informed consent by minors», sin restricción de fecha, en inglés y español, publicados antes de marzo de 2019, se ha realizado una búsqueda en las bases de datos electrónicas Medline y EMBASE, de todos los registros incluidos. Asimismo, se ha consultado literatura gris relacionada con este tópico en Google scholar e informes publicados del proyecto H2020 i-consent: Improving the guidelines of informed consent, including vulnerable populations, under a gender perspective.
Fase de cribadoSe han cribado los artículos identificados de acuerdo con los siguientes criterios:
Inclusión: Artículos que incluyen en título, palabras clave y abstract: evaluación de competencias, comprensión, capacidad de decisión y herramientas utilizadas para el CI, requerimientos legales, éticos, edad de corte del menor, contenido y legibilidad del documento de CI o asentimiento.
Exclusión: Artículos sobre CI en neonatos y lactantes, situaciones de urgencia y casos clínicos específicos incluyendo VIH, cirugías, discapacitados, aborto, contracepción y dilemas éticos y en idiomas distintos del inglés o español.
Fase de elegibilidadLos artículos elegibles se han revisado mediante lectura crítica de los títulos y abstracts, categorizándolos en 3 tópicos: Legal y ética del CI en menores; Contenido y legibilidad del CI y Valoración competencia del menor. Se ha realizado un filtro adicional de acuerdo con los siguientes criterios:
Inclusión:
- -
Artículos de revisión e Informes relacionados con normativa ética y legal internacional referidas a edad del menor para consentimiento o asentimiento de menores y normativas internacionales de investigación pediátrica.
- -
Artículos originales de estudios que evalúen herramienta para valoración competencias sobre la comprensión y capacidad de decisión del menor con población, intervención, variables y resultados que permitan realizar el análisis descriptivo y comparabilidad de los estudios incluidos.
Exclusión:
- -
Ensayos y disertaciones bioéticas sobre actitudes de menores ante el CI
- -
Estudios realizados con grupos focales de menores que no incluyen herramientas objetivas de valoración
- -
Estudio de caso e Informes breves o Cartas
- -
Artículos relacionados con contenido y legibilidad del CI
- -
Fase de inclusión
- -
Análisis de los artículos seleccionados
En la figura 1 se presenta el diagrama de selección de artículos. De los 260 registros identificados en PubMed (n=174), Embase (n=71) y Literatura gris (n=15) se han excluido 139, por presentar uno o varios criterios de exclusión. Tras categorizar los 121 artículos resultantes, finalmente se han seleccionado 13 siguiendo los criterios definidos en la fase de elegibilidad.
Revisión de la regulación legal del consentimiento del menorEn la tabla 1 se muestran los artículos sobre la legislación internacional en países con diferentes niveles de desarrollo socioeconómico y sanitario, en relación con la posición del menor en la toma de decisiones de atención médica y/o investigación.
Comparativa de normas regulatorias del CI del menor en decisiones de salud y/o Investigación
| Autor / Año | Países | Legislación aplicable | Consentimiento menor en decisiones de salud / Investigación |
|---|---|---|---|
| Mullins-Owens et al., 201214 | EE. UU. (FDA)China (SFDA)Kenia (NCST)India (ICMR) | Code of Federal Regulation C.F.R Ꞩ46 102 (i) 2009Biomedical Research involving human Ethics Review Principles art. XIV (F) 2007Guidelines for Ethical conduct of Biomedical Research involving human subjects in Kenia (2005)Ethical Guidelines for Biomedical research on human participants, ICMR guidelines (2006) | Se requiere el asentimiento del menor además del RL. Falta de consistencia en la edad y el proceso debido a las regulaciones federales y requerimientos de los Comités ÉticosNo se requiere expresamenteNo se requiere expresamente. El disentimiento del menor se respeta, excepto cuando no hay alternativa terapéuticaNo se requiere expresamente |
| Coleman y Rosoff, 201315 | EE. UU.a | Cada estado federal, por estatuto o decisión judicial | Variabilidad interestatal. Catorce permiten CI menor maduro en determinadas situaciones y 3 contemplan solo independientemente de la edad o madurezLa edad del menor varía entre 14, 15, 16 o 18 añosEn algunos estados no se define edad, en función del nivel de madurez del menor |
| Stultiëns et al., 200716 | EM de Europa que ratifican Convenio Europeo sobre derechos humanos y biomedicinab | Cada estado miembro desarrolla normativa doméstica | Cuatro situaciones diferentes:a) Edad legal decisión médica=mayoría de edad (18 años): Chipre, Grecia y Eslovaquiab) Edad legal decisión médica<mayoría de edad: Dinamarca y Eslovenia (15 a), España (16 a), Portugal (14 a)c) Edad legal decisión médica evaluada caso a caso. En función de la edad y madurez: República Checa y Estoniad) Situación b+c: Lituania |
| Palazzani et al., 201717 | EspañaItaliaReino Unido (RU)AlemaniaFranciaAustria | Trasposición nacional de la directiva 2001/20/EC y legislación domésticaAdopción reglamento Europeo de Ensayos Clínicos 536/2014 | Diferentes situaciones sobre asentimiento/consentimiento:a) RU, Italia, Francia: no requerido expresamenteb) España y Austria: requerido a los 12 y 14 años respectivamentec) Alemania: en función de la capacidad de comprensión del menor (caso a caso)Diferentes criterios de edad:a) RU y España: 16 y 12 años respectivamenteb) Italia, Alemania, Austria, Francia: 18 años (o 16 en Francia en caso de emancipamiento)Diferente definición menor maduro:a) RU y Francia: 16 años (y en Francia emancipado), competente para decidir participar en EC.b) Italia y Alemania: caso a caso, en función de la madurez del menor.c) Austria y España: 14 y 12 años respectivamente |
| Pinto Bustamante y Gulfo-Díaz18 | Colombia | Ley 1098 de 2006 (código de la infancia y adolescencia), sentencia T-411 de 1994, Sentencia T-477 de 1995, Sentencia T-474 de 1996, Sentencia C-900 de 2011 | No existe figura emancipación sanitaria ni edad definida para asentimiento. El asentimiento tiene validez legal en investigación aunque no en la práctica clínica asistencial. Definición menor adulto: 14-17 años. Capacidad relativa para ciertos actos y decisiones médicas |
| Parra Sepúlveda y Ravetllat Ballesté19 | Chile | Ley n.o 20.584 | Edad: 14-17 años. Consentimiento no vinculante. Se permite manifestar voluntad de consentir/rechazar una intervención medica |
| Casanova Torrado20 | Uruguay | Decreto 274/2010 (consentimiento informado)Ley 17.823 (Código de la Niñez y Adolescencia)Ley 18.335 (derechos y obligaciones de los pacientes)Código Ética Médico | No edad determinada. En función de la madurez y competencia del menor. Si médico considera que el menor es competente, CI no requerido de RL (solo se informa) |
Mullins et al. concluyen que la legislación de menores en investigación clínica está más ampliamente desarrollada en EE. UU. y Europa, donde se realiza el mayor volumen de estudios pediátricos, ampliándose la investigación hacia países en vías de desarrollo, como China, India y Kenia, donde la normativa está dirigida mayoritariamente a población general con vacíos legales en niños/adolescentes. En estos países, el elemento cultural desempeña un papel importante en la concepción de la capacidad de consentir del menor.
En China la toma de decisión contempla el asentimiento familiar –la autonomía se concibe más como un derecho colectivo que individual– mientras en Kenia la aproximación es más paternalista y el acceso al tratamiento tiene lugar mediante la participación en ensayos de investigación, ignorada en ocasiones por el propio sujeto participante. La regulación jurídica que garantiza la protección de los niños sujetos de investigación posee escasa vigencia, debido a cuestiones socioeconómicas.
En la normativa de India (ICMR) se establece el principio de precaución y minimización del riesgo para la población en general, sin profundizar en consideraciones específicas para niños, en contraste con la situación de EE. UU., donde se requiere que el protocolo ofrezca un beneficio potencial directo al menor y que la investigación conlleve el mínimo riesgo o un ligero incremento sobre el mínimo riesgo. La mayoría de los Estados no permiten que el menor consienta por sí mismo en el ámbito de la práctica asistencial, y si bien existen excepciones a este principio, se requiere siempre la evidencia de la madurez y la capacidad del menor para decidir, sin que se exija la realización de una evaluación formal de la misma.
En el análisis comparativo de la regulación europea sobre la posición de los menores en decisiones de salud en la práctica clínica, realizado por Stultiëns et al., se ha analizado el régimen jurídico del menor en 9 de los Estados miembros que han ratificado la Convención Europea sobre Derechos humanos y Biomedicina. Se aprecia que la normativa doméstica es variable, así como la edad y las circunstancias en las que los menores pueden tomar decisiones de salud de forma autónoma.
Una comparación entre la regulación del consentimiento del menor en Europa y en los EE. UU. permite concluir que los Estados europeos contemplan un mayor empoderamiento del menor en intervenciones que afectan a su salud. El informe señala que «en ciertas situaciones que consideran la naturaleza y gravedad de la intervención, así como la edad del menor y su capacidad de comprensión, la opinión del menor debería progresivamente tener mayor peso en la decisión final».
En la investigación clínica en Europa, tal y como se analiza por Palazzani et al. existe heterogeneidad de regulaciones jurídicas respecto a la edad en la que el menor puede consentir por sí mismo para participar en una investigación. En todos los países, se requiere el consentimiento del representante legal del menor como subrogado en la toma de decisión y la edad del menor para prestar el consentimiento/asentimiento no es la misma que la mayoría de edad, como es el caso de España, Austria y Reino Unido. En los demás países analizados, no se establece un límite: el asentimiento se basa en la valoración de la madurez del menor por el investigador, con una aproximación caso por caso.
En Latinoamérica cabe afirmar que el tratamiento normativo del menor ha evolucionado hacia un reconocimiento y promoción de su autonomía en la toma de decisiones médicas. Cada uno de los países analizados (Uruguay, Colombia y Chile) ha desarrollado una normativa nacional incorporando diferentes elementos, partiendo de una base bioética común basada en el niño como sujeto de derechos. En algunos de los países se acepta el consentimiento único del menor adolescente, si el profesional sanitario lo considera suficientemente maduro.
Evaluación de competencias del menor en el consentimiento informado en investigación o en decisiones de saludEn la tabla 2 se presentan los estudios que abordan la evaluación de competencia del menor para el CI en investigación o en decisiones de salud con una herramienta objetivable de valoración. En 4 de estos trabajos se utilizó como instrumento de valoración para protocolos de investigación la entrevista semiestructurada McCarthur Competency Assessment Tool for Clinical Research adaptada para niños y adolescentes (MacCAT-T, MacCAT-CR).
Comparativa de estudios en los que se realiza evaluación de competencias del menor: comprensión y capacidad de decisión
| Autor, añoDiseño del estudio | Población | Tamaño muestral/Estrato etario (años) | País/es | Herramienta evaluación competencias | Conclusiones en la evaluación de competencias en el proceso consentimiento informado (para investigación o decisiones de salud) |
|---|---|---|---|---|---|
| Hein et al., 201521Estudio piloto | Pacientes ambulatorios con riesgo de enfermedad cardiaca hereditaria autosómica dominante (elegibles para test genético predictivo) | N=176-18 | Holanda | MacCAT-T (MacArthur Competence Assessment Tool for Treatment) | La herramienta MacCAT-T es viable en esta poblaciónEdad<10 años se consideraron incompetentesEdad 12-18 años se consideran competentes para CI |
| Nelson et al., 201622Estudio piloto | Sujetos ambulatorios y de comunidad | N=3014-21 | Estados Unidos | MacCAT-CR (MacArthur Competence Assessment Tool for Clinical Research)REALM (Rapid Estimate of Adult Literacy in Medicine) para evaluar nivel de alfabetización salud | La herramienta MacCAT-CR adaptada para adolescentes es viable y muestra asociaciones significativas con el nivel de alfabetización en salud y el estado socioeconómico |
| Koelch et al., 200923Estudio viabilidad | Pacientes con trastornos psiquiátricos (trastorno déficit de atención/ hiperactividad [TDAH]) o TDAH combinado con trastorno desafiante oposicional (TDO) participantes en 2 ensayos clínicos terapéuticos | N=197-15 | Alemania | MacCAT-CR (MacArthur Competence Assessment Tool for Clinical Research) | Los sujetos>12 años (mejor que los de 9-12) demostraron ser competentes en aspectos prácticos de la investigación: procedimientos, molestias, inconvenientes. Principio autonomía bien comprendidoConceptos más abstractos como objetivo principal, placebo: capacidad apreciación baja, en línea con el nivel de apreciación de los padresSe sugiere la necesidad de reforzar y mejorar la información del CI en los aspectos más abstractos de los ensayosSe observan indicadores de concepto terapéutico errado tanto en los menores como en los padresSe sugiere que la herramienta MacCAT-CR es un instrumento consistente pero requiere mayor desarrollo y adaptación |
| Hein et al., 201424Estudio prospectivo | Niños hospitalizados o de consultas externas (alergología, gastroenterología, oncología, oftalmología, neumología) elegibles para estudios de investigación | N=1616-18 | Holanda | MacCAT-CR (MacArthur Competence Assessment Tool for Clinical Research) | La herramienta MacCAT-CR dispone de propiedades psicométricas robustas para evaluar la capacidad de decisión en menores y tiene una sólida correlación con la edadEn niños entre 9 y 11 se podría considerar el consentimiento formal cuando se puede demostrar su competencia con MacCAT-CR |
| Espejo et al., 201125Estudio cuantitativo, observacional, transversal | Adolescentes estudiantes de 3.o-4.o ESO (ámbito rural y urbano) | N=6014-15 | España | EVC (Escala de Valoración de Competencia)DIT de Rest (Definid Issue Test): desarrollo juicio moralEscalas tipo Likert: valoración capacidad cognitiva y madurez (VCCM) | La escala EVC podría ser válida y fiable para valorar competencia moral de toma de decisiones de adolescentes 14 a 15 años, en materia de saludAlta correlación entre EVC y VCCM. No se observa entre EVC y DIT |
| Gibson et al., 201126Estudio descriptivo cualitativo | Investigadores con 3-30 años de experiencia en investigación pediátrica | N=14No aplica | Canadá | Análisis cualitativo de entrevistas cara a cara realizadas a los investigadores | Se sugiere la implicación de la familia (menores y padres) en el proceso de consentimiento, de forma conjunta y simultánea preferiblemente (vs. individualmente)La evaluación de la capacidad del menor no se realiza de forma sistemática, limitándose a la edad del menor o normas establecidas |
Aunque existen limitaciones en el tamaño muestral y diseño en 3 de los 4 estudios que utilizan esta herramienta, en todos ellos se indica la viabilidad de su aplicación en niños, así como sus consistentes propiedades psicométricas y su fiabilidad y precisión para determinar la capacidad del menor.
El empleo de la herramienta demuestra un nivel de competencia suficiente para consentir en menores a partir de 12 años, siendo el nivel de comprensión superior al de los padres en pacientes con síndrome TDAH y TDH, según Koelch. En el estudio de Nelson, con adolescentes de 14-21 años, la edad fue uno de los predictores independientes de la puntuación de MacCAT, unida al nivel de alfabetización en salud y el estatus socioeconómico. En el estudio de Hein, con diseño prospectivo, n=160 en un rango amplio entre 6 y 18 años, con niños hospitalizados y ambulatorios, se concluyó que la edad era un buen factor predictivo de competencia en la puntuación MacCAT-CR. Asimismo, se concluyó que, entre 9 y 11 años, está justificado que los menores consintieran por sí mismos cuando se pueda demostrar su competencia a nivel individual, empleando MacCAT-CR.
El estudio de Espejo, realizado en España, valoró las competencias de estudiantes en el consentimiento para toma de decisiones sanitarias en la clínica asistencial utilizando la Escala de Valoración de Competencia (EVC), test DIT de James Rest, para medir el desarrollo del juicio moral y 2 escalas tipo Likert para valoración de la capacidad cognitiva y madurez. En este trabajo se concluye que la EVC es un instrumento adecuado de valoración de competencia moral en alumnos de 14 y 15 años, y se podría utilizar en situaciones clínicas concretas, teniendo en cuenta que hay otros factores que pueden condicionar su uso, tales como situaciones de urgencia o de gravedad.
Por último, el estudio descriptivo cualitativo de Gibson realiza una evaluación de las competencias, conocimiento y habilidades de los investigadores durante el proceso de CI con menores en protocolos de investigación. Se muestra la existencia de una gran variabilidad de percepciones entre los investigadores y de discrepancias entre los requerimientos de los Comités éticos y la práctica asistencial, así como la ausencia de una evaluación sistemática de la capacidad del menor, al que se permite o no consentir en función de la edad de corte definida normativamente. Se sugiere la implicación de la familia en el proceso de consentimiento, de forma conjunta y preferiblemente simultánea.
DiscusiónLos resultados de esta revisión corroboran que, a pesar de la existencia de un marco de referencia común en los códigos éticos internacionales, cada estado ha desarrollado su propia normativa doméstica con relación a cuándo y sobre qué tipo de decisiones sanitarias pueden consentir por sí mismos los menores.
En EE. UU. y Europa, el concepto de autonomía del menor está más ampliamente desarrollado, si bien se requiere el consentimiento de los padres o representantes legales en la mayoría de las intervenciones médicas (especialmente en EE. UU., debido a la extensión de la medicina defensiva)27. Las excepciones a este requerimiento se producen, básicamente, en materia de interrupción voluntaria del embarazo y anticoncepción, donde se prescinde en ocasiones del consentimiento paterno, y en investigación, donde se protege especialmente a los menores. Las decisiones de los adultos han de tomarse en aras del «mejor interés» del menor, principio jurídico básico que supone la ponderación del caso concreto y los derechos y necesidades del menor implicado. A nivel práctico, es aquí donde se pueden generar conflictos entre los diferentes actores: clínicos, padres y los propios sujetos menores en situaciones extremas graves de salud o sin otras alternativas terapéuticas, para cuya resolución habría de recurrirse a Comités de Ética asistencial28.
La situación es distinta en países en vías de desarrollo con menor tradición en investigación clínica, donde el rol de la familia y los padres tiene mayor peso debido a condicionantes culturales y sociosanitarios, y en los que la participación en ensayos se convierte en única vía de acceso a algunos tratamientos. No obstante, los países latinoamericanos cuya legislación se ha analizado muestran una normativa que reconoce los derechos, autonomía y participación activa en la toma de decisiones de salud, introduciendo el concepto de bienestar superior, menor maduro y la autonomía progresiva29; si bien, en Chile y Uruguay posiblemente se necesitaría un desarrollo legal específico en el ámbito de la investigación clínica en menores.
En Europa, el análisis de 9 de los Estados adscritos al Convenio Europeo sobre derechos humanos y biomedicina arroja diferencias sustanciales: Solo 3 (España, Dinamarca y Portugal) establecen una edad inferior a la mayor edad civil para la toma de decisiones sanitarias, y otros 3 (Chequia, Estonia y Lituania) consideran la edad y la madurez del menor para toma de decisiones de salud.
En España, el menor puede consentir por sí mismo en el ámbito sanitario, en general, a partir de los 16 años, o tras su emancipación, exceptuándose de este régimen «la práctica de ensayos clínicos y la práctica de técnicas de reproducción humana asistida», para las que rige la mayoría de edad civil30, y aquellas intervenciones que supongan un riesgo grave para su salud, en las que la decisión corresponde a los padres, si bien es preceptivo tener en cuenta la opinión del menor mayor de 16.
Tras la reforma de 2015, desaparece de la ley de autonomía del paciente la obligación de escuchar y tener en cuenta la opinión del menor mayor de 12 años, si bien algunos autores sugieren que estos menores podrían tener la competencia clínica suficiente como para tomar una decisión sobre intervenciones que respectan a su salud en determinados casos24.
En el caso de ensayos clínicos, es imprescindible contar con el CI de los padres o representantes legales del menor (hasta la mayor edad civil, 18) y, además, con el asentimiento (el legislador no emplea esta palabra, sino que usa «consentimiento») del menor mayor de 12. El RD 1090/2015 establece, además, la obligación de oír al menor de 12, si tuviera juicio suficiente.
La edad no es el único factor que determina la competencia del menor para la toma de decisión. La evaluación de esta competencia es compleja, pues la madurez es un proceso evolutivo donde intervienen la maduración del juicio moral, el desarrollo cognitivo, la afectividad y la situación médica del menor25. No obstante, puede afirmarse que la aparición del pensamiento moral convencional se produce entre los 10 y 12 años. A través de la revisión presentada, se confirma que el menor a partir de 12 años posee competencia para la toma de decisión en el ámbito médico, según se demuestra en los estudios que han empleado la herramienta MacArthur adaptada a población pediátrica. Este instrumento, basado en un modelo cognitivo de capacidad mental, se trata de una entrevista semiestructurada de preguntas agrupadas en 4 dimensiones: comprensión, apreciación, razonamiento y expresión de elección. Aunque más ampliamente utilizado en población psiquiátrica adulta8, también en niños y adolescentes demuestra ser un instrumento válido y fiable con propiedades psicométricas consistentes. Además, se evidencia la alta sensibilidad y especificidad de esta herramienta entre los 9,6 y 11,2 años, lo que hace pensar que, en este rango, y cuando se pueda demostrar individualmente la competencia del menor para consentir, debería recabarse su consentimiento/asentimiento. Aunque la EVC desarrollada por Espejo et al., podría ser válida y fiable para la valoración de competencia en adolescentes, se autolimita a la toma de decisiones sanitarias, y no se ha utilizado en investigación clínica ni en menores de 12 años, por lo que tiene mayores limitaciones en el ámbito de aplicación.
Los estudios que utilizan instrumentos de valoración de competencia y su tamaño muestral son aún limitados, por lo que es importante ampliar la investigación sobre la valoración de la competencia en menores, lo que permitiría dotar de un instrumento sólido a los investigadores y clínicos, y aconsejaría la modificación de la regulación al respecto.
ConclusionesLa revisión de estudios que utilizan herramientas validadas en estudios en población pediátrica, y específicamente en investigación clínica, evidencia que la entrevista semiestructurada McCarthur adaptada a población de adolescentes es la que resulta ser más precisa, completa y consistente para evaluar la competencia en la toma de decisión. A falta de ulteriores estudios que puedan aportar mayor evidencia al respecto, los menores mayores de 12 años son competentes para la toma de decisiones de carácter sanitario, y entre los 9 y los 12 años se puede demostrar su competencia a nivel individual, empleando la citada herramienta.
La regulación jurídica del CI para la investigación pediátrica debería ser receptiva a estas evidencias científicas y recabar el asentimiento del menor como requisito imprescindible para su reclutamiento en todo caso, cuando sea mayor de 12 años, y antes a partir de los 9, cuando se demuestre su competencia para asentir.
Para formarse un juicio sobre esta competencia, tanto el investigador como el clínico deben emplear herramientas de evaluación validadas y adecuadas, como ha demostrado ser la entrevista semiestructurada MacArthur.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.
Los autores agradecen a Clara Ramírez, becaria del departamento médico de GSK, el apoyo en la realización de este trabajo.
Presentación previa en congresos: Congreso Asociación Española de Bioética (Valencia, 25-26 Octubre 2019).