La hipotensión arterial es un signo frecuente en recién nacidos críticamente enfermos. Varios estudios clínicos señalan que series cortas de corticoides aumentan la PA y disminuyen el requerimiento de inotrópicos en prematuros con hipotensión. Existe escaso número de estudios de empleo de hidrocortisona para el tratamiento de la hipotensión refractaria en recién nacidos (RNT). El objetivo de este estudio es evaluar la eficacia de la hidrocortisona (HC) para la reducción del soporte inotrópico en RNT con hipotensión arterial refractaria.
Material y métodosSe incluyó a todos los RNT con requerimientos de dopamina ≥ 14μg/k/min y/o epinefrina. Diseño: prospectivo, controlado, aleatorizado, doble ciego con placebo.
IntervenciónHC: 2,5mg/kg c/12 h, por 48 h por vía intravenosa (IV) (grupo intervención [GI]); placebo: solución fisiológica 1,25ml/kg/dosis IV (grupo placebo [GP]). Se efectuó aleatorización en bloques con asignación oculta.
ResultadosIngresaron al estudio 50 RNT con hipotensión refractaria. No se observaron diferencias significativas entre los 2 grupos. La reducción del soporte inotrópico a las 48h en el GI se alcanzó en el 60% de los pacientes vs. el 24% en el GP (p=0,009, RR = 2,5, IC del 95%, 1,16 a 5,38). Se observó una asociación significativa entre la administración de HC en RNT tratados con epinefrina y la presencia de hiperglucemia (p = 0,008).
ConclusiónLa administración de HC en pacientes con hipotensión refractaria redujo la necesidad de soporte inotrópico. Estos datos contribuyen a continuar investigando acerca del papel de los esteroides en el soporte hemodinámico de pacientes críticos.
Systemic hypotension is a common sign in critically sick infants. Several studies have suggested that the use of short series of corticosteroids increases arterial blood pressure and reduces the inotropic support needs in preterm neonates with hypotension. There are a small number of reports on the use of hydrocortisone (HC) for the treatment of refractory hypotension in infants.
Material and methodsTo assess the effectiveness of hydrocortisone in the reduction of inotropic support in infants with refractory hypotension. Population: infants who required dopamine ≥ 14μg/kg/min and/or epinephrine.
Designprospective, controlled, randomized, double blind trial with placebo.
InterventionHC: 2.5mg/kg every 12hours, for 48hours intravenously (intervention group [IG]); placebo: isotonic saline 1.25ml/kg/doses intravenously (placebo group [PG]) every 12hours, for 48hours. Randomization was performed in blocks with blind assignment.
ResultsA total of 50 infants with refractory systemic hypotension were prospectively recruited. Patient characteristics were similar in both groups. Requirements for inotropic support at 48hrs were achieved in 60%, of the IG versus 24% of the PG (P=.009, RR: 2.5, 95% CI, 1.16-5.38). A significant association was observed between the administration of HC in infants treated with epinephrine and the presence of hyperglycemia (P =.008).
ConclusionIn patients with refractory hypotension hydrocortisone administration reduced the need for inotropic support. Further studies with a greater number of patients are needed to confirm the effectiveness of HC as a therapeutic tool in these infants.
La hipotensión arterial es un signo frecuente de RN críticamente enfermos hospitalizados en la Unidad de Cuidados Intensivos Neonatales (UCIN). Se estima que, aproximadamente, la mitad de los pacientes que ingresan a una UCIN recibirá algún tratamiento destinado a elevar su presión arterial (PA) con el fin de preservar el flujo a órganos vitales, como sistema nervioso central, miocardio y riñón1,2. Los tratamientos actuales para el tratamiento de la hipotensión son los expansores de volumen y los inotrópicos (dopamina, dobutamina, epinefrina, norepinefrina)3,4. La mayoría de los RN con hipotensión arterial responde al tratamiento convencional; sin embargo, existe un grupo de RN extremadamente enfermos (asfixia severa, cirugías prolongadas y complejas, shock séptico, hipertensión pulmonar) que presentan gran inestabilidad hemodinámica con hipotensión refractaria al tratamiento convencional5. Se denomina hipotensión refractaria a aquella que persiste pese a haberse instaurado la terapéutica máxima (dosis elevadas de inotrópicos y expansores). Se postula que este fenómeno se debe a una desensibilización gradual de los receptores del sistema cardiovascular a las catecolaminas (down-regulation) que involucra una destrucción de los mismos por los lisosomas. Esta down-regulation se produciría después de varias horas de exposición de los receptores a altas dosis de catecolaminas endógenas o exógenas6,7. Por otro lado, en distintas situaciones clínicas se ha publicado la presencia de insuficiencia suprarrenal absoluta o relativa que podría contribuir a esta resistencia al efecto de los fármacos vasoactivos. Sin embargo, no todos los niños con bajo nivel de cortisol presentaran hipotensión refractaria, e inversamente, niños con concentraciones de cortisol dentro del rango normal pueden desarrollar un cuadro clínico con severo compromiso hemodinámico5.
La posibilidad de emplear corticoides para el tratamiento de la hipotensión refractaria a la terapéutica convencional se ha investigado en adultos8, en pacientes pediátricos9,10 y en RN prematuros11–13. Los corticoides regulan la expresión de los receptores adrenérgicos y de algunos integrantes del sistema del segundo mensajero (efectos genómicos), estimulan el ensamblaje del receptor a las catecolaminas en la superficie celular, disminuyen el metabolismo de las catecolaminas y aumentan la disponibilidad de calcio intracelular3,14,15. El Hospital Juan P. Garrahan es un hospital pediátrico de tercer nivel, sin maternidad, que pertenece al sector público de salud. Los RN que ingresan a la terapia intensiva neonatal son todos derivados por alguna afección que no pudo ser resuelta en la maternidad de origen. Un alto porcentaje de los niños que ingresan a la terapia intensiva se encuentran críticamente enfermos, con inestabilidad hemodinámica. Si este cuadro no se revierte con el tratamiento convencional, no es infrecuente la administración de una serie corta de HC; sin embargo, la utilidad de este tratamiento no ha sido demostrada hasta la actualidad.
El objetivo de este estudio es establecer si la administración de hidrocortisona (HC) comparada con placebo reduce la necesidad de soporte inotrópico en niños nacidos a término con hipotensión arterial refractaria al tratamiento. De forma secundaria, se evaluó el efecto de la HC sobre los parámetros hemodinámicos, la mortalidad y la aparición de efectos adversos a corto plazo vinculados a su administración.
Material y métodos- –
Población: se reclutó prospectivamente a 50 RNT con hipotensión refractaria. Los criterios de inclusión fueron: edad gestacional ≥ 37 semanas; hipotensión sistémica a pesar de tratamiento con expansores de volumen (solución salina isotónica 10-20ml/kg) y dopamina ≥ 14μg/kg/min por, por lo menos, 2 h. Cada paciente que cumplía con los criterios de elegibilidad fue ingresado en forma consecutiva al estudio luego de la firma del consentimiento informado por su madre, padre o cuidador principal
- –
Se consideraron criterios de exclusión: pacientes con malformaciones mayores o alteraciones cromosómicas letales, con hiperplasia suprarrenal congénita, con shock hipovolémico o hemorrágico, con cardiopatía congénita con obstrucción del tracto de salida del ventrículo izquierdo o que hubieran recibido corticoides posnatales.
- –
Diseño: estudio prospectivo, doble-ciego, aleatorizado, controlado con empleo de placebo, desarrollado en el Área de Terapia Intensiva Neonatal del Hospital de Pediatría Prof. Dr. J.P. Garrahan, Buenos Aires, Argentina.
- –
Aleatorización: se empleó un mecanismo de aleatorización simple en bloques de 4 generada mediante tabla de números aleatorios. La secuencia se encontraba oculta mediante sobres opacos, en la farmacia del hospital, y no estaba disponible al resto de los investigadores.
- –
Implementación: 2 farmacéuticos (MT, ML) eran los encargados de definir la asignación y preparar el producto (placebo o HC). Ellos eran los únicos que conocían el contenido de cada jeringa; las mismas eran dejadas preparadas, numeradas, listas para ser utilizadas en la UCIN. Para asegurar el cegamiento del estudio, ambos fármacos (HC o placebo) eran del mismo color, sin olor, diluidos en el mismo volumen de administración y equivalentes a una dosis de 2,5mg/kg de HC. Cada paciente recibió un curso de tratamiento de 2 días con succinato de sodio de HC2,5mg/kg por dosis por vía intravenosa cada 12 h o solución salina isotónica como placebo.
- –
Medida de efecto primario: la intervención se consideró eficaz si se lograba el descenso del soporte inotrópico a las 48 h de ingreso al estudio; dicho descenso fue definido como disminución de la dosis de dopamina al 50% del valor inicial y/o suspensión de la administración de epinefrina.
- –
Criterios de eliminación: glucemia mayor a 300 mg %, a pesar de haber disminuido el flujo de glucosa hasta 4mg/kg/min o hemorragia digestiva (hematemesis o melena). En estos casos, se suspendía la administración del tratamiento; los datos eran incorporados al análisis final según intención de tratamiento.
- –
Tratamiento de la hipotensión: se definió hipotensión como una PA media menor que el percentil 5 para horas/días de vida y peso16. De acuerdo con el consenso de tratamiento en nuestra Unidad, la secuencia de tratamiento en pacientes nacidos a término con hipotensión sistémica es la siguiente: inicialmente se indica uno a 2 bolos de solución salina 10ml/kg/dosis a modo de expansión; si las 2 expansiones de volumen no son suficientes, se agrega dopamina a 5-10μg/kg/min, que se aumenta en forma paulatina hasta lograr la PA deseada. Se reserva el empleo de dobutamina a aquellos pacientes con trastornos de la contractilidad. Si no se logra el efecto esperado con estos inotrópicos, se indica epinefrina a 0,1μg/kg/min. No se emplean de rutina productos de la sangre, como glóbulos rojos o plasma fresco o plaquetas, a menos que el paciente presente anemia, trastornos de la coagulación o trombocitopenia.
- –
A los fines del estudio, se consideró hipotensión refractaria cuando después de 2 h de tratamiento (2 expansiones de volumen y dopamina ≥ 14μg/kg/min y/o inicio de epinefrina) la PA continuaba en valores inferiores a los normales.
- –
Mortalidad: el análisis de la mortalidad se efectuó dentro de los 15 días del ingreso de cada paciente al protocolo.
El estudio fue abierto; el neonatólogo a cargo del paciente, ciego a la rama asignada, podía administrar corticoides fuera de protocolo si lo consideraba necesario según su criterio clínico; en todos los casos, se registraba dicho tratamiento como una cointervención.
Las variables de estudio recogidas fueron: edad gestacional, peso de nacimiento y peso de ingreso al protocolo causa de internación de cada paciente. Se registró la PA (mediante método invasivo o no invasivo) sistólica, diastólica y media inmediatamente antes de la intervención y a las 2, 6, 12, 24 y 48 h; adicionalmente, se recolectaron los valores de frecuencia cardiaca, flujo urinario, aporte de volumen intravenoso de líquidos, dosis y tipo de inotrópicos usados, valores de glucemia y otras cointervenciones terapéuticas en los mismos intervalos; se registró sistemáticamente la aparición de hemorragia digestiva, presencia de signos de infección y/o sepsis confirmada y evolución general hasta 15 días luego de la inclusión del paciente en el protocolo.
El estudio fue aprobado por el Comité revisor institucional y por el Comité de Ética del Hospital Garrahan (N.° de registro: 729/04) y por el ente regulador en Argentina, ANMAT, en marzo del 2005, bajo la categoría de investigador independiente (Disp.N.°1674.N.° exp.1-0047-0000-01284-02-5).
- –
Análisis estadístico: la estadística descriptiva se expresó mediante media o mediana « desviación estándar o intervalo intercuartílico y porcentaje. Se empleó el test de Student o U Mann Whitney para variables continuas y la prueba de la chi al cuadrado para categóricas. Adicionalmente, se construyeron curvas de Kaplan Meier para estimar el efecto de la intervención sobre el descenso de vasopresores durante el tiempo de seguimiento del estudio; el análisis comparativo se realizó mediante log Rank test. Los resultados se expresan mediante riesgo relativo, número necesario a tratar e intervalo de confianza [IC] del 95%. Se empleó STATA 9.0 para Windows como paquete estadístico (Statacorp, Texas, EE. UU.). Se estableció un nivel de significación del 5% para todas las comparaciones. Los resultados de todos los pacientes incluidos en el estudio se analizaron según intención de tratamiento.
Para el cálculo del tamaño muestral se emplearon datos previos de la unidad que mostraban una tasa de respuesta favorable basal del 10%. Se calculó la necesidad de reclutar 21 pacientes en cada rama para demostrar una diferencia relevante en el efecto (estimado como un aumento del 10 al 60% de la respuesta luego del tratamiento con corticoides) con un poder del 90% (error β=0,10) y un error α de 0,05 (a 2 colas).
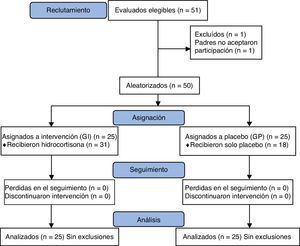
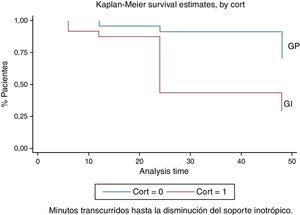
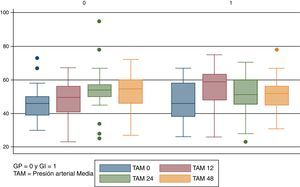
ResultadosDe un total de 51 niños con criterios de elegibilidad, ingresaron 50 al protocolo. Un solo paciente fue excluido por falta del consentimiento familiar. Se aleatorizó a 25 pacientes al grupo Intervención (GI) y 25 pacientes al grupo placebo (GP); 31 niños recibieron HC y 19 placebo, ya que se trató de un estudio abierto, donde el médico tratante podía indicar corticoides si lo consideraba necesario. Los 6 pacientes que recibieron corticoides pertenecían al grupo placebo. En la figura 1 se presenta el flujograma de los sujetos de estudio en todas las etapas de acuerdo con las recomendaciones del Grupo CONSORT17. Los grupos GI y GP resultaron similares al inicio del estudio (tabla 1). Las causas principales de hospitalización de los pacientes ingresados al estudio fueron: hipertensión pulmonar (n=23), cardiopatías congénitas (n=18) y afección quirúrgica (n=9). De los RN con hipertensión pulmonar, 11 eran pacientes con hernia diafragmática congénita, 4 con síndrome de aspiración de líquido amniótico meconial, 4 con hipertensión pulmonar primaria, 3 con neumonías y uno con malformación adenomatoidea quística. El motivo de indicación de HC fue hipotensión refractaria debida a shock séptico en el 34% de los casos. El descenso del soporte inotrópico durante el periodo de seguimiento se produjo en 21 de los 50 pacientes ingresados al estudio, 15 pacientes (60%) pertenecían al GI y 6 pacientes (24%) al GP. Esta diferencia resultó estadísticamente significativa, p = 0,009; RR 2,5 (IC del 95%, 1,16-5,38). El número necesario de pacientes a tratar sobre la base de esta diferencia es de 2,77. Adicionalmente, exploramos si la disminución del soporte inotrópico era diferente durante el transcurso del estudio, para lo cual se midió el tiempo (h) en que cada paciente alcanzaba el evento de interés (descenso del soporte inotrópico). En la figura 2 se observa que existen diferencias en ambas curvas de supervivencia a favor del grupo tratado, en el que la respuesta esperada se produce más precozmente en forma significativa (log Rank test 0,02) No se encontraron diferencias estadísticamente significativas en el resto de las variables hemodinámicas estudiadas: frecuencia cardiaca, PA o flujo urinario a las 2, 6 12, 24 y 48 h de la intervención. En la figura 3 se representan los valores de la PA de ambos grupos en los intervalos de 0. 12, 24 y 48 h. El 84% de los pacientes (42/50) requirieron el uso de expansión de volumen adicional durante el estudio; el requerimiento de expansiones frecuentes (> 2) fue más frecuente en el grupo placebo (32%) vs. el intervención (24%), si bien esta diferencia no fue estadísticamente significativa. En la tabla 2 se presentan los efectos adversos en ambos grupos; no hubo diferencias significativas en la presencia de complicaciones atribuidas al tratamiento con HC. La hiperglucemia fue más frecuente en los pacientes que recibieron epinefrina (14/28, 50%); en cambio, entre los pacientes que no recibieron este fármaco solo uno presentó hiperglucemia. Esta diferencia fue significativa y demostró la asociación entre hiperglucemia y el empleo de epinefrina (p=0,008). No se observaron diferencias entre los grupos en el resto de los efectos adversos (tabla 2). Fallecieron 10 de los 50 pacientes (20%); 3 pertenecían al GI (12%) y 7 al GP (28%) (p=0,15, RR 0,42, IC del 95%, 0,12-1,42); a pesar de que esta diferencia de evolución en nuestra muestra parece relevante, el estudio no fue diseñado para establecer el efecto sobre mortalidad y, por lo tanto, no ha tenido el poder estadístico suficiente que permita inferir si el uso de corticoides puede estar relacionado con disminuir la mortalidad en este grupo de niños con alto riesgo de vida por su condición inicial.
Características de las poblaciones tratadas con hidrocortisona o con placebo al inicio del estudio
| Hidrocortisona (25) | Placebo (25) | p | |
| Días de vidaa | 7 (2-20) | 6 (3-19) | 0,80 |
| Peso (g), media±DE | 2.936±680 | 3.184±805 | 0,24 |
| Sexo masculino, n (%) | 11 (44%) | 12 (48%) | 0,77 |
| EG (s), media±DE | 38±1,4 | 38±1,8 | 0,67 |
| Dosis de dopamina (μg/kg/min)a | 18 (14-20) | 17 (9-18) | 0,39 |
| Dosis epinefrina (μg/k/min)a | 0,5 (0,5-0,7) | 1 (0,3-1) | 0,80 |
| Flujo urinario (ml/kg/h)a | 2,55 (1,3-3,6) | 2,6 (1-3) | 0,65 |
| Volumen de infusión (ml/kg)a | 60 (40-70) | 60 (60-80) | 0,33 |
| Presión arterial media (mmHg)a | 46 (38-58) | 46 (39-50) | 0,63 |
| Frecuencia cardiaca (ciclos/min)a | 168 (150-180) | 153 (143-167) | 0,08 |
DE: desviación estándar; EG: edad gestacional.
El empleo de corticoides para el manejo del soporte hemodinámico en niños ha sido propuesto en numerosos estudios. Aunque los resultados no son concluyentes, en aquellos pacientes con hipotensión refractaria al tratamiento con volumen y vasopresores algunos autores recomiendan su uso18. Existe un número mayor de estudios en el periodo neonatal RN pretérmino19–23 que en el de RNT (5, 15). En un estudio reciente aleatorizado, controlado y ciego, Ng et al. evalúan la efectividad de una dosis de estrés de HC(1mg/kg cada 8h por 5 días) vs. placebo para el tratamiento de rescate en prematuros de muy bajo peso con hipotensión refractaria e insuficiencia adrenal. El resultado mostró que el 79% de los pacientes tratados con HC vs. el 33% del grupo placebo logró suspensión del soporte inotrópico dentro de las 72h de iniciado el tratamiento19.
En pacientes pediátricos con hipotensión de causa infecciosa o en recuperación de cirugía cardiovascular, se han desarrollado diversos estudios que muestran una mejoría hemodinámica luego de la administración esteroides23–25. En las guías clínicas desarrolladas por el American College of Critical Care Medicine para neonatos y niños con shock séptico, el comité mantiene la «equipoise» en lo que se refiere al tratamiento coadyuvante con corticoides en el tratamiento de la sepsis en edad pediátrica, con excepción de la insuficiencia adrenal o del eje hipotálamo-hipofisario. Estas guías proponen agregar HC al tratamiento de neonatos en riesgo de insuficiencia adrenal definida como un valor pico de cortisol luego de estimulación con hormona adrenocorticotropa<18μg/dl o un valor basal de cortisol<18μg/dl luego de la expansión adecuada y epinefrina10.
Con respecto a la experiencia publicada en RNT, Baker et al. reportaron un estudio retrospectivo de 117 RN con hipotensión refractaria (61 pacientes con peso de nacimiento > 2.500g) tratados con un protocolo estandarizado de HC. A pesar de que la población de este estudio era heterogénea, la administración de HC estuvo asociada uniformemente con un aumento en la PA, una disminución en la dosis de inotrópicos y un aumento de la diuresis. Estos resultados fueron independientes de la edad gestacional, el peso de nacimiento y el valor basal del cortisol antes del inicio del tratamiento26.
En 1999, Tantivit et al. reportaron su experiencia en 7 RNT con hipotensión refractaria a los que les administraron dexametasona. En todos los RN se observó una disminución del requerimiento de inotrópicos, de la necesidad de expansiones y un aumento de la diuresis27.
Noori et al., en un estudio observacional y prospectivo, evaluaron si la administración de HC se asociaba a cambios hemodinámicos en RN que recibían altas dosis de dopamina. Los resultados mostraron que a las 48 h del tratamiento con HC, la dosis de dopamina disminuyó un 72% y la PA y el volumen sistólico aumentaron 31 y un 33%, respectivamente28.
Kamath et al. evaluaron la presencia de insuficiencia adrenal en 34 RNT con hernia diafragmática congénita. Observaron que 67% de los pacientes presentaron niveles bajos de cortisol plasmático (< 15μg/dl) y que esta situación se asoció a mayor severidad de la enfermedad. En este reporte, el 100% de los pacientes con niveles bajos de cortisol y el 69% de los pacientes con cortisol alto recibieron corticoides como parte de su tratamiento29.
Como podemos observar, los estudios en RNT son retrospectivos o con escaso número de pacientes. Nuestro estudio, a pesar de ser prospectivo, controlado y con un número mayor de pacientes, adolece de algunas debilidades. La población estudiada constituye un grupo de niños derivados desde maternidades por enfermedades graves, donde el impacto del traslado agrega morbilidad a la enfermedad de base30. La mortalidad global de la UCIN es de alrededor del 5%; sin embargo, este grupo de pacientes pertenece al grupo de los de mayor criticidad, lo que explicaría su elevada mortalidad. En nuestro estudio, la medición de resultados estuvo basada en el criterio clínico del neonatólogo, que tiene en cuenta el valor de la PA asociado a la evaluación de la perfusión del paciente (diuresis, relleno capilar, temperatura de las extremidades), para tomar decisiones sobre el manejo de inotrópico. Por último, en nuestro estudio no se documentó la insuficiencia suprarrenal a través del dosificación de cortisol plasmático para establecer el papel de la insuficiencia suprarrenal en esta población.
Finalmente, si bien en este estudio no se ha observado una diferencia significativa en la aparición de eventos adversos a corto plazo, aún no se ha evaluado el impacto a largo plazo de esta intervención, sobre todo en relación con el desarrollo neurológico de estos niños. Todos estos pacientes se encuentran en seguimiento. Este estudio mostró que el tratamiento con HC disminuyó los requerimientos de inotrópicos en la población estudiada. Basados en esta información, consideramos razonable el empleo de bajas dosis de HC en RNT que permanecen hipotensos a pesar de altas dosis de vasopresores. La dosis óptima diaria, la duración del tratamiento y la necesidad de medir de rutina los valores de cortisol plasmático son aún aspectos que deberían ser determinados. Si bien el empleo de corticoides no puede aun ser recomendado en la práctica asistencial para el manejo de la hipotensión en estos pacientes, es posible que su administración pueda ser considerada en casos refractarios, siempre y cuando el clínico considere cuidadosamente cada caso y la unidad acuerde un protocolo estandarizado que permita la evaluación de los resultados a corto y largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el equipo médico y de Enfermería del Servicio de Neonatología del Hospital de Pediatría Juan P. Garrahan, ya que gracias a su apoyo incondicional hicieron posible la realización de este estudio.
Presentado en 46.a Reunión de la Sociedad Latinoamericana de Investigación Pediátrica 2008. Sociedad Iberoamericana de Neonatología. Cusco, Perú, septiembre del 2008.