Las lesiones cutáneas son una causa habitual de demanda en la consulta del niño viajero, siendo después de la fiebre y la diarrea, el motivo de consulta más frecuente. Estas lesiones permiten la ventaja de un diagnóstico «de visu» y el inconveniente de que a veces la lesión es el único signo que nos va a dar el diagnóstico.
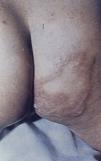
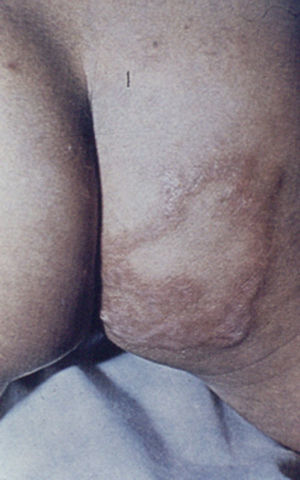
Presentamos un niño de 2 años, adoptado, originario de Perú, que consulta a los 10 días de su llegada. Refiere 4 deposiciones líquidas al día fétidas, no vómitos, anorexia ni fiebre. Exploración: retraso ponderal leve, abdomen distendido sin visceromegalias y discreto retraso psicomotor. A nivel perianal y en glúteos varias lesiones lineales eritematosas (fig. 1). Analítica: 15.700 leucocitos (13% eosinófilos; 2.041eosinófilos/μl), resto normal. Mantoux de 0mm de induración. Heces: se aísla Giardia lamblia. Serologías: sífilis, VHB, VHC, VIH negativas, VHA IgG positiva. Debido al alto grado de eosinofilia y a las lesiones perianales, se realiza serología para parásitos, con serología a Strongyloides stercoralis (Ss): ELISA título 1–2 (optimetría. Cut off>0,5). No se aisló en heces Ss en ningún momento. Se diagnostica de giardiasis y probable estrongiloidiasis. El paciente recibe tratamiento con metronidazol para la giardiasis y posteriormente con una dosis diaria de ivermectina (200μg/kg/día) durante 2 días para el Ss. Tras el tratamiento con ivermectina, se observó desaparición de las lesiones perianales, negativización de los títulos de anticuerpos en los siguientes 9 meses, así como desaparición de la eosinofilia al año del tratamiento.
Presentamos un niño con lesiones cutáneas típicas de Ss, denominada «larva currens». La «larva currens» es característica del nemátodo Ss, helminto que presenta eritema cutáneo en común con algún Anquilostoma, por penetración de larvas infectivas a través de la piel. Ss se diferencia del resto de helmintos, en que puede realizar su ciclo biológico completo dentro del hombre, con capacidad de reinfección en el mismo y además de su ciclo en tierra. Es por tanto fundamental el diagnóstico y tratamiento adecuados para evitar la cronicidad en el hombre, sobretodo ante posibles situaciones de inmunodepresión1,2.
Existen 2 especies de Strongyloides relevantes para el hombre: Ss y Strongyloides fuelleborni, que pueden cursar con una clínica que va desde eosinofilia asintomática hasta hiperinfestación masiva en pacientes inmunocomprometidos. Ciclo biológico: las larvas de Ss penetran a través de la piel intacta, por el torrente circulatorio alcanzan los alvéolos pulmonares, siendo deglutidas hasta el duodeno donde maduran a larvas adultas. Sus huevos eclosionan produciendo larvas rabditiformes (no infectantes) que se eliminan en heces o pueden evolucionar a larvas filariformes (infectantes) que atraviesan la mucosa intestinal realizando el mismo ciclo infeccioso que en la primoinfección. A este proceso se le llama «autoinfección interna», pudiendo presentar clínica gastrointestinal3. La larva infectante puede descender hasta la zona perianal y penetrando por la piel reproduciendo también el ciclo infectivo, con lesiones cutáneas típicas de «larva currens», ciclo denominado de «autoinfección externa».
Un dato constante es la eosinofilia moderada o my elevada, siendo en ocasiones el único signo de infección. La «larva currens» puede asociar edema, eritema y lesiones serpinginosas. Suele localizarse en zona perianal, glúteos, tórax, muslos y extremidades inferiores. Presenta un desplazamiento muy rápido de unos 5–15cm/hora, como una urticaria lineal, siendo transitoria y pudiendo durar horas o pocos días, y se caracteriza por ser alternante, desapareciendo en un lugar y reapareciendo en otro, pudiendo recurrir durante semanas o años, o bien autolimitarse3. Pacientes inmunodeprimidos, pueden desarrollar una púrpura petequial en abdomen y raíz de extremidades4. Debemos sospechar estrongiloidiasis en niños con dolor abdominal, diarrea o cuadro malabsortivo sin filiar, procedentes de zonas endémicas, asociado a eosinofilia inexplicable y/o urticaria recurrente5. El diagnóstico se confirma mediante la detección de larvas en heces, que se objetivan en menos del 75% de los pacientes, debido a que la eliminación del parásito es intermitente. Habitualmente el diagnóstico se sospecha tras la visualización de las lesiones cutáneas sugestivas y eosinofilia inexplicada. A estos pacientes debe realizarse pruebas serológicas (centros de referencia), que detecten anticuerpos frente al Ss, utilizando el antígeno de la larva del parásito, y que tiene alta sensibilidad pero baja especificidad (29%) ya que pueden tener reacciones cruzadas con otros parásitos (toxocariasis, hidatidosis, filariasis, Necator americanus y otros)6,7. Tras la terapia, es necesario repetir analítica hasta confirmar la normalización de los valores de eosinófilos y de la serología, cuantificando la disminución de anticuerpos8. El tratamiento de elección es ivermectina 200μg/kg/día, una dosis durante 2 días, que debe solicitarse a través de medicamentos extranjeros en nuestro medio. La alternativa es tiabendazol que no está disponible actualmente, pudiendo utilizarse albendazol a 200–400mg/día repartido en 2 dosis durante 3–5 días9.
El diagnóstico diferencial debe realizarse con otras lesiones cutáneas como la «larva migrans cutánea» o la filariasis, teniendo en cuenta la diferente prevalencia según las áreas geográficas. La «larva migrans cutánea», es producida por el Ancylostoma brazilensis, principal agente etiológico, y también producido mas raramente por Ancylostoma duodenale, Ancylostoma caninun, Uncinaria stenophala, Bunostomum phlebotonum y N. americanus. El nemátodo se introduce a través de heridas en la piel y clínicamente comienza con una pápula eritematosa en la zona de penetración y posteriormente lesión eritematoserpiginosa intensamente pruriginosa de 15–20cm de longitud y 2–4mm de ancho y puede avanzar hasta un centímetro diario10. Algunas especies de filarias, pueden producir lesiones cutáneas: Loa loa: edema de calabar; Onchocerca volvulus: nódulos subcutáneos, oncocercomas, y Mansonella perstans y streptocerca: lesiones dérmicas en niños de mayor edad11. Otras lesiones dérmicas en el diagnóstico diferencial son: Gnathosomiasis y miasis cutáneas.
Nuestra experiencia clínica se basa en pacientes inmigrantes, adoptados, y niños viajeros procedentes de zonas tropicales, concluyendo que es muy importante realizar una adecuada historia clínica, recogiendo país de procedencia, tiempo de permanencia, exposición a alimentos, agua, animales, evolución de la lesión y síntomas acompañantes, así como un examen físico detallado, siendo obligado incluir el estudio de eosinofilia.