En la embarazada expuesta a tuberculosis (TB) no se recomienda profilaxis primaria con isoniazida salvo en gestantes inmunodeprimidas, con enfermedades crónicas o factores de riesgo obstétrico y antecedente de contacto íntimo mantenido con un enfermo bacilífero. En la infección tuberculosa latente (ITBL) se iniciará profilaxis con isoniazida si existe contacto reciente con TB o factores de riesgo de progresión a TB activa. En caso contrario, se retrasará hasta al menos 3 semanas después del parto. El tratamiento de la enfermedad tuberculosa es el mismo que fuera de la gestación. Los recién nacidos de madres con historia gestacional de TB diseminada o extrapulmonar, con TB activa en el parto o con contacto TB posnatal conocido, asintomáticos y con pruebas diagnósticas negativas, deben recibir profilaxis primaria con isoniazida durante al menos 12 semanas. Transcurrido ese tiempo se repiten los test diagnósticos, y si son negativos, se interrumpe la profilaxis. En la ITBL, se administrará isoniazida durante 9 meses. En la enfermedad tuberculosa, el tratamiento es el mismo que en el niño mayor pero mantenido al menos 9 meses. Se recomienda aislamiento respiratorio en la TB congénita y en la TB posnatal con baciloscopia positiva en jugo gástrico o aspirado bronquial. La separación madre-hijo solo está indicada en madres que han recibido tratamiento durante menos de 2 semanas, presentan baciloscopia positiva o tienen TB resistente. La lactancia materna no está contraindicada y en las situaciones de separación la madre puede extraerse la leche para que sea administrada en biberón al recién nacido.
In pregnant women who have been exposed to tuberculosis (TB), primary isoniazid prophylaxis is only recommended in cases of immunosuppression, chronic medical conditions or obstetric risk factors, and close and sustained contact with a patient with infectious TB. Isoniazid prophylaxis for latent tuberculosis infection (LTBI) is recommended in women who have close contact with an infectious TB patient or have risk factors for progression to active disease. Otherwise, it should be delayed until at least three weeks after delivery. Treatment of TB disease during pregnancy is the same as for the general adult population. Infants born to mothers with disseminated or extrapulmonary TB in pregnancy, with active TB at delivery, or with postnatal exposure to TB, should undergo a complete diagnostic evaluation. Primary isoniazid prophylaxis for at least 12 weeks is recommended for those with negative diagnostic tests and no evidence of disease. Repeated negative diagnostic tests are mandatory before interrupting prophylaxis. Isoniazid for 9 months is recommended in LTBI. Treatment of neonatal TB disease is similar to that of older children, but should be maintained for at least 9 months. Respiratory isolation is recommended in congenital TB, and in postnatal TB with positive gastric or bronchial aspirate acid-fast smears. Separation of mother and infant is only necessary when the mother has received treatment for less than 2 weeks, is sputum smear-positive, or has drug-resistant TB. Breastfeeding is not contraindicated, and in case of mother-infant separation expressed breast milk feeding is recommended.
Se recomienda no administrar profilaxis y repetir la prueba de tuberculina (PT) y/o una técnica de detección de interferón gamma en sangre (interferon gamma release assay [IGRA]) transcurridas 8-12 semanas, ya que las infecciones muy recientes pueden producir test negativos en la primera determinación. Únicamente, se valorará la posibilidad de iniciar profilaxis primaria con isoniazida hasta la repetición de los test diagnósticos en las gestantes con contacto íntimo y mantenido con un enfermo bacilífero si presentan inmunosupresión, enfermedades crónicas o factores de riesgo obstétrico. En las gestantes con inmunodepresión grave la profilaxis debe administrarse durante 6 meses aunque presenten PT/IGRA repetidos negativos, dada la menor sensibilidad de los test en situaciones de inmunosupresión.
Infección tuberculosa latente- –
Infección tuberculosa latente (ITBL) con profilaxis pregestacional. Si se inicia la profilaxis de la ITBL y la paciente se queda embarazada posteriormente, se debe continuar el mismo régimen hasta completarlo1.
- –
ITBL sin contacto reciente ni factores de riesgo de progresión a tuberculosis (TB) activa. Si tras el estudio de contactos no se consigue documentar un contacto tuberculoso reciente y la embarazada no tiene factores de riesgo de progresión (infección por el virus de la inmunodeficiencia humana, inmunosupresión, uso de drogas por vía parenteral, residencia en condiciones de hacinamiento o marginación social), se aconseja retrasar la profilaxis con isoniazida hasta al menos 3 semanas después del parto para minimizar el riesgo fetal y el riesgo de hepatitis materna gestacional y puerperal2,3. Los hijos de madres tratadas con isoniazida y alimentados con leche materna, deben recibir suplementos de piridoxina (1-2mg/kg/día).
- –
ITBL con contacto reciente o factores de riesgo de progresión a TB activa. Deberá instaurarse la profilaxis lo antes posible, independientemente de las semanas de gestación (incluso en el primer trimestre)4. El fármaco indicado es la isoniazida (5-10mg/kg/día en dosis única; dosis máxima 300mg) durante 6 meses. En caso de que los comprimidos no tengan asociada vitamina B6, debe añadirse un suplemento de piridoxina (10-50mg/día) para prevenir el desarrollo de neuropatía periférica. La isoniazida puede producir hepatotoxicidad por citólisis durante el embarazo y el posparto, habiéndose descrito casos de hepatitis fulminante y muerte materna5. Por ello se recomienda comprobar antes de iniciar el tratamiento que la gestante tenga transaminasas séricas normales, y repetir este análisis siempre antes del primer mes y a los 1, 2, 4 y 6 meses del inicio del tratamiento.
En caso de intolerancia grave o resistencia a la isoniazida, se empleará rifampicina (10mg/kg/día; dosis máxima 600mg) durante 4 meses. Uno de sus principales efectos adversos es la hepatitis con colestasis, por lo que se deberán controlar las enzimas hepáticas de forma similar a las tratadas con isoniazida.
En las gestantes que vayan a recibir tuberculostáticos se debe interrogar sobre antecedentes de enfermedad hepática crónica, y consumo de alcohol u otros fármacos hepatotóxicos, ya que la frecuencia y gravedad de la toxicidad hepática aumentan con la presencia de estos factores2,6.
Enfermedad tuberculosaEl tratamiento antituberculoso debe instaurarse cuando se demuestre la presencia de Mycobacterium tuberculosis mediante reacción en cadena de la polime-rasa o cultivo en cualquier muestra biológica o se constate inflamación granulomatosa en una muestra tisular de una paciente con clínica compatible. No obstante, en gestantes con clínica o radiología altamente indicativas de enfermedad o con sospecha de enfermedad grave, como meningitis o diseminación miliar, el tratamiento se iniciará de forma urgente, sin esperar los resultados microbiológicos o de anatomía patológica.
- –
Tratamiento de primera línea. El tratamiento de la tuberculosis en la embarazada es el mismo que el recomendado fuera de la gestación. Consiste en la asociación de isoniazida (5-10mg/kg/día; dosis máxima 300mg), rifampicina (10mg/kg/día; dosis máxima 600mg), pirazinamida (25-30mg/kg/día; dosis máxima 2.000mg) y etambutol (15-20mg/kg/día; dosis máxima 1.600mg) durante 2 meses, seguido de isoniazida más rifampicina 4 meses más, siendo el total de tratamiento de 6 meses. La pirazinamida no se usó durante años por la falta de datos sobre su teratogenicidad. Sin embargo, no se han descrito efectos secundarios fetales en mujeres tratadas, por lo que en la actualidad la mayoría de las sociedades científicas la recomiendan como tratamiento de primera línea7. El etambutol puede suspenderse cuando se constate la sensibilidad del aislamiento a los 3 fármacos de primera línea.
En la meningitis tuberculosa se completará un total de 12 meses de tratamiento. En la meningitis y pericarditis tuberculosas se administrarán además corticoides en las primeras semanas de tratamiento por su acción antiinflamatoria. La dosis aconsejada es de 0,5-1mg/kg/día de metilprednisolona durante un mes, con disminución progresiva hasta retirarla a los 2 meses. La toxicidad hepática por isoniazida, pirazinamida y rifampicina es uno de los efectos adversos principales del tratamiento. Cuando aparezca clínica de hepatitis y las transaminasas se eleven más de 3 veces su valor normal o en un control analítico sin clínica se observe un aumento por encima de 5 veces su valor normal, se suspenderá el tratamiento hasta su normalización. Posteriormente, se irán reintroduciendo los fármacos de primera línea de forma progresiva2,6. En caso de recurrencia, se utilizará una pauta de tratamiento con fármacos no hepatotóxicos.
- –
Tratamiento de segunda línea. Se utilizará en gestantes con resistencia o intolerancia a los fármacos de primera línea y se recomienda siempre consultar a un experto en TB. Se recomienda iniciarlo a partir del segundo trimestre de embarazo, aunque puede comenzarse en el primero en caso de enfermedad grave. Están contraindicadas estreptomicina, amikacina, kanamicina y capreomicina (categoría D), ya que pueden causar sordera congénita. Debe evitarse la utilización de etionamida/protionamida, ya que existe escasa experiencia durante la gestación y hay riesgo de teratogenicidad, y las quinolonas (moxifloxacino, levofloxacino), al haberse descrito casos de afectación ósea fetal. Podrían utilizarse, cuando no hay otras alternativas de tratamiento, cicloserina y ácido paraaminosalicílico (categoríaC), aunque no se dispone de datos de seguridad en el embarazo ni en el feto2,7,8.
Cuando las gestantes reciben antirretrovirales se aconseja realizar el tratamiento antituberculoso de primera línea referido anteriormente, siempre que se administren 2 análogos de nucleósidos en combinación con efavirenz (evitando este fármaco durante las 8 primeras semanas de gestación)9, raltegravir o nevirapina8-10. En caso de no poder utilizar estas combinaciones y ser obligado el uso de un inhibidor de proteasa, puede sustituirse la rifampicina por rifabutina, ajustando la dosis, ya que tiene menor interacción con los inhibidores de la proteasa11,12. En esta situación, se debería considerar realizar monitorización de niveles terapéuticos de antirretrovirales.
SeguimientoEl control del tratamiento debe ser estricto para asegurar su cumplimiento, su eficacia y detectar los efectos secundarios de los fármacos. En la mayoría de las pacientes será suficiente hacer controles a los 15 días, al mes y a los 2, 4 y 6 meses de tratamiento, con evaluación radiográfica y microbiológica cuando se considere necesario.
LactanciaExcepto en el caso de mastitis tuberculosa, la enfermedad tuberculosa durante la gestación o el puerperio no contraindica la lactancia materna siempre y cuando la madre haya recibido 2 semanas de tratamiento adecuado, no sea bacilífera, la cepa sea sensible a los fármacos de primera línea y el recién nacido esté recibiendo profilaxis con fármacos antituberculosos. Si no se cumple alguna de estas condiciones, la madre puede extraerse la leche para que sea administrada en biberón al recién nacido. M. tuberculosis no se transmite por la leche materna y las pequeñas concentraciones de los fármacos en la leche no producen efectos tóxicos significativos en el lactante. Sin embargo, deben utilizarse con precaución los fármacos de segunda línea por su escasa experiencia y su potencial toxicidad. Los hijos de madres tratadas con isoniazida, cicloserina o etionamida/protionamida que reciban lactancia materna deben recibir suplementos de piridoxina (1-2mg/kg/día)2,7,12.
Profilaxis y tratamiento de la tuberculosis neonatalLa profilaxis de la ITBL y de la enfermedad tuberculosa en el neonato se basa en la terapia con antituberculosos de 1.ª línea (tabla 1). Las dosis que se utilizan son las recomendadas en el lactante mayor de 3 meses, aunque no se dispone de datos farmacológicos que validen su seguridad o eficacia por debajo de esta edad13. Es, por tanto, fundamental un seguimiento clínico cercano para monitorizar su eficacia terapéutica y su potencial toxicidad.
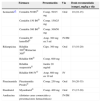
Presentaciones disponibles, vía de administración y dosis recomendadas de los fármacos antituberculosos de primera línea en España
| Fármaco | Presentación | Vía | Dosis recomendada (rango), mg/kg y día | |
|---|---|---|---|---|
| Isoniazidaa,b | Cemidón 50 B6© | Comp. 50/15mg | Oral | 10 (10-15) |
| Cemidón 150 B6© | Comp. 150/25mg | |||
| Cemidón 300 B6© | Comp. 300/50mg | |||
| Cemidón IV lento/IM© | Amp. 300mg en 5ml | IV/IM | ||
| Rifampicina | Rifaldin 300©/Rimactan 300© | Cáps. 300mg | Oral | 15 (10-20) |
| Rifaldin 600© | Comp. 600mg | |||
| Rifaldin suspensión© | Jarabe 20mg/ml | |||
| Rifaldin 600 IV© | Amp. 600mg en 10ml | IV | ||
| Pirazinamida | Pirazinamida Prodes© | Comp. 250mg | Oral | 30 (20-35) |
| Etambutol | Myambutol© | Comp. 400mg | Oral | 15 (15-20) |
| Amikacina | (distintas casas comerciales y presentaciones farmacéuticas) | IV/IM | ||
Otro problema añadido es la ausencia de presentaciones comerciales adecuadas para el lactante en España, con la excepción de rifampicina en suspensión. En algunas farmacias hospitalarias se realizan fórmulas magistrales con presentaciones adecuadas para el neonato. Debe instruirse a los padres o cuidadores en la preparación y la administración del tratamiento, en los problemas de tolerancia y en los efectos adversos que se deben vigilar. El tratamiento debe administrarse en una sola toma diaria y en ayunas para facilitar su absorción; esto puede ser dificultoso en el neonato, en quien se recomendará administrar el tratamiento justo antes de la toma y, a ser posible, guardar unos minutos de ayuno posterior14.
La adherencia al tratamiento antituberculoso es fundamental para garantizar el éxito terapéutico. La OMS y los Centers for Disease Control and Prevention recomiendan el tratamiento antituberculoso directamente observado en cualquier paciente pediátrico15. En España, no se dispone en la mayoría de centros de esta posibilidad, aunque puede ser necesaria en casos seleccionados, especialmente en situaciones de riesgo social y en casos de resistencias farmacológicas.
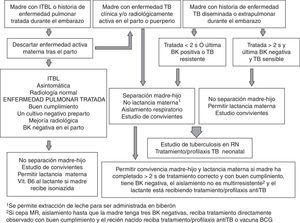
Exposición a tuberculosisLos recién nacidos de madres con historia gestacional de TB diseminada o extrapulmonar, con TB activa en el momento del parto, o con contacto posnatal conocido, asintomáticos y con todas las pruebas de primer nivel negativas, deben recibir profilaxis primaria con isoniazida. La profilaxis puede no administrarse si la madre tiene historia de TB pulmonar o pleural no complicada durante la gestación, está recibiendo un tratamiento correcto con buen cumplimiento, tiene al menos un cultivo de esputo negativo, no es bacilífera en el momento del parto y se ha excluido minuciosamente la TB en el medio familiar. En estos casos se recomienda un seguimiento clínico estrecho del niño, con controles de PT e IGRA al nacimiento y cada 3-4 meses, hasta el año de vida. En casos dudosos, o que no cumplan todos los criterios anteriores, se realizarán todas las pruebas de primer nivel, y si son negativas y el niño está asintomático, se iniciará tratamiento profiláctico.
La profilaxis con isoniazida debe mantenerse durante al menos 12 semanas16. Transcurrido ese tiempo, se repiten la PT y el test IGRA y, si son negativos, se interrumpe el tratamiento, aunque debe realizarse un seguimiento estrecho con repetición de los test diagnósticos a los 6 y 12 meses de vida, dada su menor sensibilidad en el periodo neonatal. En caso de que la cepa del caso índice presente resistencia a isoniazida, se administrará como profilaxis rifampicina (10-15mg/kg/día) durante al menos 12 semanas16. Si el aislamiento es resistente a isoniazida y rifampicina (multirresistente), puede optarse por iniciar pautas alternativas (p. ej., con una fluoroquinolona) o mantener una vigilancia clínica estrecha sin tratamiento, repitiendo los test diagnósticos al mes y medio, y a los 3, 6 y 12 meses.
En el recién nacido con un contacto de alto riesgo (madre con tuberculosis grave o diseminada próxima al parto o en el puerperio o contacto posnatal muy íntimo, muy prolongado o con un caso índice muy bacilífero), la profilaxis puede alargarse hasta tener un control negativo de los test diagnósticos a los 6 meses de vida. En lactantes prematuros, desnutridos o inmunodeprimidos, en los cuales la sensibilidad de la PT y los test IGRA es menor, puede valorarse completar la profilaxis durante 9 meses como si se tratara de una ITBL, aunque todos los resultados sean negativos o, al menos, mantenerla hasta 3 meses después de que el caso índice haya negativizado los cultivos.
Infección tuberculosa latenteLos neonatos con PT o IGRA positivos, asintomáticos y con todas las pruebas diagnósticas de primer y segundo nivel negativas, deben recibir profilaxis secundaria con isoniazida durante 9 meses16. En caso de resistencia a isoniazida confirmada, se recomienda una pauta de 6 meses de rifampicina (10-15mg/kg/día)16. El riesgo de hepatotoxicidad y la falta de datos en edades tan tempranas desaconsejan la pauta combinada de isoniazida más rifampicina durante 3 meses, aunque facilita la adherencia y puede ser útil en casos seleccionados, especialmente si se sospecha resistencia a isoniazida en el caso índice.
En neonatos que reciben isoniazida se recomienda de rutina asociar vitamina B6 (1-2mg/kg/día), que habitualmente se incluye en nuestro medio en un único comprimido de isoniazida-B6 (50-15mg o 150-25mg).
En el lactante con ITBL por cepa multirresistente, se recomienda consultar con un experto. Pueden utilizarse pautas de biterapia con pirazinamida y etambutol, u otros 2 fármacos con actividad confirmada, con tratamiento directamente observado durante 9-12 meses, aunque no está establecida la combinación más adecuada, el tiempo de tratamiento ni su efectividad.
Enfermedad tuberculosaComo en el adulto y el niño mayor, el tratamiento de la enfermedad tuberculosa neonatal se compone de una fase de inducción y una fase de mantenimiento. En la fase de inducción, se recomienda combinar 4 tuberculostáticos de 1.ª línea durante 2 meses, utilizando siempre isoniazida, rifampicina, pirazinamida y, como cuarto fármaco, amikacina o etambutol17. El cuarto fármaco debe retirarse cuando se constate la sensibilidad del aislamiento del paciente o del caso índice a los otros 3 fármacos de primera línea. Habitualmente, se prefiere el etambutol por su administración por vía oral y su menor toxicidad, ya que la neuritis óptica es infrecuente si no se sobrepasan las dosis recomendadas. Sin embargo, es preferible la amikacina como tratamiento de inicio en caso de enfermedad grave o diseminada o afectación del sistema nervioso central.
En la fase de mantenimiento, tras comprobar una adecuada evolución clínica, se combinan isoniazida y rifampicina a las dosis habituales y con un tiempo de tratamiento que depende del tipo de enfermedad, de la gravedad inicial y de la evolución del paciente. En la TB neonatal se recomienda un tiempo mínimo de tratamiento de 9 meses17,18, aunque debe alargarse hasta un mínimo de 12 meses en las formas diseminadas o con afectación meníngea, y hasta los 18-24 meses en la TB multirresistente. No se recomiendan las pautas intermitentes de tratamiento de 2 o 3 veces por semana.
En la enfermedad tuberculosa en que el patógeno es resistente a fármacos de 1.ª línea, la selección de la pauta terapéutica se rige por las mismas normas que en la enfermedad del niño mayor. Sin embargo, la ausencia de datos farmacológicos específicos para muchos de los antituberculosos de 2.ª línea en el periodo neonatal dificulta aún más el tratamiento, por lo que se recomienda siempre consultar con un experto.
La corticoterapia está claramente indicada en la afectación del sistema nervioso central, la TB miliar y ante una compresión bronquial por una adenopatía. También puede ser útil en las formas extrapulmonares con importante componente inflamatorio (pleuritis o pericarditis). Se utiliza prednisona (1-2mg/kg/día) o equivalente, al menos durante 4-6 semanas, que deberá interrumpirse después de forma progresiva15,18. Se deben considerar las dosis de prednisona o su equivalente en el rango más elevado por su interacción con rifampicina.
Medidas de aislamiento respiratorioLa TB congénita asocia cargas bacilares altas en secreciones respiratorias y jugo gástrico en el neonato, y requiere de medidas de aislamiento del entorno, en especial si permanece ingresado en una unidad neonatal, hasta negativizar la baciloscopia19. Por tanto, se recomienda realizar una baciloscopia de control a los 15 días del inicio del tratamiento antituberculoso, que se repetirá al mes en caso de que persista positiva. La TB posnatal, al contrario, raramente es contagiosa y no precisa de medidas de aislamiento20, salvo en los casos que presenten baciloscopia positiva en jugo gástrico o aspirado bronquial.
Las medidas a tomar en el recién nacido o lactante en contacto con un paciente con enfermedad tuberculosa y potencialmente contagioso, habitualmente la madre, se resumen en la figura 12,15,18.
Vacunación con bacilo de Calmette-GuérinLa vacuna BCG está contraindicada durante la gestación11. En el recién nacido, la OMS recomienda la vacunación sistemática en países de alta endemia21. En España, no está incluida en el calendario vacunal de ninguna comunidad autónoma y únicamente debería considerarse en las siguientes circunstancias: 1) viaje para estada prolongada (> 3 meses) o definitiva a países con alta incidencia de TB y que tienen incluida la vacuna BCG en su calendario; 2) exposición a madre u otro conviviente con TB multirresistente o extremadamente resistente, dado el riesgo de recidiva de la TB en el seno familiar, incluso con tratamiento adecuado17; 3) ITBL neonatal por cepa multirresistente o extremadamente resistente, ya que en esta situación no está demostrada la eficacia de la profilaxis y la vacuna puede prevenir las formas diseminadas de TB en los primeros años de vida17, y 4) contacto íntimo y prolongado con paciente diagnosticado de TB bacilífera y mal cumplimiento terapéutico, cuando no se puedan realizar o hayan fracasado otras estrategias de prevención. En estas circunstancias, si el recién nacido está recibiendo profilaxis primaria o secundaria, la vacuna se administrará tras completar el periodo de profilaxis.
Seguimiento del lactante con infección tuberculosa latente o enfermedad tuberculosaEl seguimiento clínico del lactante en tratamiento con fármacos antituberculosos consiste en visitas frecuentes (al menos mensuales al inicio del tratamiento), para monitorizar la evolución clínica, la adecuada adherencia al tratamiento y su posible toxicidad. Se recomienda la realización periódica de analítica sanguínea para monitorizar la función hepática (isoniazida, rifampicina y pirazinamida), hiperuricemia (pirazinamida) y función renal (aminoglucósidos). En caso de utilizar aminoglucósidos, es conveniente realizar potenciales auditivos al finalizar el tratamiento y es recomendable una valoración oftalmológica con potenciales evocados visuales si se emplea etambutol17.
Ante una adecuada evolución clínico-radiológica de la enfermedad TB, no es necesario repetir sistemáticamente la radiografía de tórax y el seguimiento clínico debería alargarse al menos hasta los 2 años de vida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo de trabajo de tuberculosis gestacional, congénita y posnatal de la SEIP: Ana Alarcón Allen, Servicio de Neonatología, Hospital Universitari Sant Joan de Déu, Esplugues de Llobregat, Barcelona y Unidad de Neonatología, Oxford University Hospitals NHS Trust, Reino Unido; Fernando Álvez González, Unidad de Infectología y Vacunas, GENVIP, Hospital Clínico Universitario Santiago de Compostela, A Coruña; Fernando Baquero-Artigao, Servicio de Pediatría, Enfermedades Infecciosas y Patología Tropical, Hospital Infantil La Paz, Madrid; Daniel Blazquez Gamero, Sección de Inmunodeficiencias y Niños Pequeños, Servicio de Pediatría, Hospital 12 de Octubre, Madrid; Marta Cabrera Lafuente, Servicio de Neonatología, Hospital La Paz, Madrid; José Antonio Couceiro Gianzo, Unidad de Infectología, Servicio de Pediatría, Complexo Hospitalario de Pontevedra; María de la Calle Fernández-Miranda, Unidad de Tocología de Alto Riesgo, Servicio de Obstetricia y Ginecología, Hospital La Paz, Madrid; Teresa del Rosal Rabes, Servicio de Pediatría, Enfermedades Infecciosas y Patología Tropical, Hospital Infantil La Paz, Madrid; Claudia Fortuny Guasch, Unidad de Infecciones, Servicio de Pediatría, Hospital Sant Joan de Déu, Universitat de Barcelona, Esplugues de Llobregat, Barcelona; Anna Goncé Mellgren, Servicio de Medicina Maternofetal, Institut Clínic de Ginecologia, Obstetrícia i Neonatologia, Hospital Clínic, Barcelona; Teresa Hernández-Sampelayo Matos, Sección de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Gregorio Marañón, Madrid; Andrea Martín-Nalda, Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Materno-Infantil Vall d’Hebron, Barcelona; Leticia Martínez Campos, Unidad de Infectologia Pediátrica, Hospital La Inmaculada de Huercal Overa, AGS Norte de Almería; María José Mellado Peña, Servicio de Pediatría, Enfermedades Infecciosas y Patología Tropical, Hospital Infantil La Paz, Madrid; María Mendez Hernández, Servicio de Pediatría, Unidad de Enfermedades Infecciosas e Inmunología Clínica, Hospital Universitario Germans Trias i Pujol, Universidad Autónoma de Barcelona; David Moreno Pérez, Unidad de Infectología, Hospital Materno-Infantil Carlos Haya, Málaga; María Luisa Navarro Gómez, Sección de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Gregorio Marañón, Madrid; Antoni Noguera Julián, Unidad de Infecciones, Servicio de Pediatría, Hospital Sant Joan de Déu, Universitat de Barcelona, Esplugues de Llobregat, Barcelona; Félix Omeñaca Teres, Servicio de Neonatología, Hospital La Paz, Madrid; José Tomás Ramos Amador, Servicio de Pediatría, Hospital Clínico San Carlos, Madrid.