El hemocultivo (HC) es el método diagnóstico de elección ante la sospecha de bacteriemia, siendo una de las técnicas microbiológicas más solicitadas en pediatría. Diversos cambios han acontecido en los últimos años como la introducción de nuevas vacunas, el aumento creciente de pacientes portadores de catéteres vasculares centrales, o la irrupción de los sistemas automáticos de procesamiento de los HC. Dichos cambios han propiciado la revisión y la actualización de los distintos aspectos relacionados con esta técnica con el fin de optimizar su uso. Se presenta una guía práctica sobre recomendaciones acerca de la extracción, el procesamiento y la interpretación de los HC elaborada por la Sociedad Española de Urgencias de Pediatría y la Sociedad Española de Infectología Pediátrica. Tras revisar la información científica disponible, se presentan una serie de recomendaciones para cada uno de los siguientes apartados: indicaciones en Urgencias, técnica de extracción, transporte y procesamiento de la muestra, factores a tener en cuenta en situaciones especiales (indicaciones e interpretación de resultados en el paciente inmunodeprimido y/o portador de catéter vascular central, indicaciones de HC para anaerobios), diferenciación entre bacteriemia y contaminación ante un HC con crecimiento bacteriano y actitud a tomar ante un HC positivo en el paciente con fiebre sin foco
Blood culture (BC) is the gold standard when a bacteraemia is suspected, and is one of the most requested microbiological tests in paediatrics. Some changes have occurred in recent years: the introduction of new vaccines, the increasing number of patients with central vascular catheters, as well as the introduction of continuous monitoring BC systems. These changes have led to the review and update of different factors related to this technique in order to optimise its use. A practice guideline is presented with recommendations on BC, established by the Spanish Society of Paediatric Emergency Care and the Spanish Society for Paediatric Infectious Diseases. After reviewing the available scientific evidence, several recommendations for each of the following aspects are presented: BC indications in the Emergency Department, how to obtain, transport and process cultures, special situations (indications and interpretation of results in immunosuppressed patients and/or central vascular catheter carriers, indications for anaerobic BC), differentiation between bacteraemia and contamination when a BC shows bacterial growth and actions to take with a positive BC in patients with fever of unknown origin
El hemocultivo (HC) es una de las técnicas microbiológicas más solicitadas en pediatría. La detección de bacteriemia es esencial, ya que puede asociarse a una notable morbimortalidad. Por otro lado, diferenciar una bacteriemia de un HC contaminado contribuiría a disminuir costes asociados a estos últimos. Asimismo, es necesario restringir la indicación de HC a aquellos pacientes con riesgo incrementado de bacteriemia.
En los últimos tiempos diversos cambios acontecidos han modificado la epidemiología de la bacteriemia. La incorporación de nuevas vacunas ha conllevado importantes cambios en la incidencia y etiología de la bacteriemia. Además, el aumento del número de pacientes inmunocomprometidos, portadores de catéteres intravasculares y receptores de antibióticos de amplio espectro, ha propiciado la aparición de bacteriemias por microorganismos que en el pasado eran causa muy rara de infección o eran considerados contaminantes. Por otro lado, la irrupción de los sistemas automatizados para los HC ha permitido una disminución significativa del tiempo de emisión de los resultados, así como un incremento de su positividad.
Ante este nuevo escenario, el Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Urgencias de Pediatría, y un grupo ad hoc de la Sociedad Española de Infectología Pediátrica han revisado y actualizado la bibliografía existente acerca de esta prueba microbiológica.
Indicaciones de extracción de hemocultivo en UrgenciasNo existe un consenso sobre las indicaciones de extracción de HC en las Urgencias Pediátricas. En el caso de las infecciones focales, la información es limitada y en los pacientes con fiebre sin foco (FSF) el nuevo escenario tras la introducción de las nuevas vacunas ha modificado la pauta de actuación1-6 .Las recomendaciones se dividen en 3 grupos según la rentabilidad diagnóstica demostrada (tablas 1 y 2).
Indicaciones de extracción de hemocultivos en pacientes con fiebre sin foco en Urgencias
| Se recomienda siempre extracción ante la sospecha de: Sepsis/shock séptico/shock tóxico Sospecha de meningococcemia Estudio por fiebre prolongada Lactantes < 3 meses con fiebre sin focalidad Paciente que ingresa para tratamiento antibiótico parenteral por sospecha de infección bacteriana Fiebre en pacientes inmunodeprimidos Paciente que acude por fiebre a la vuelta del trópico |
| Considerar extraer en: Lactantes de 3-36 meses con FSF >39°C y vacunación antineumocócica incompleta |
| No se recomienda extracción de rutina: Lactantes > 3 meses con FSF con adecuado estado general y con vacunación antineumocócica completa |
Indicaciones de extracción de hemocultivos en infecciones localizadas en Urgencias
| Grupo A. Se recomienda extracción ante la sospecha de: Meningitis bacteriana Endocarditis Infección osteoarticular (artritis/osteomielitis) Neumonía grave Neumonía complicada (necrosante, absceso, derrame pleural, empiema, neumatocele…) IPPB: IPPB profundas (piomiositis, fascitis necrosante) y IPPB superficiales complicadas (secundaria a traumatismo, infección de herida quirúrgica, úlcera, quemadura o mordedura, herida por inmersión, pericatéter, material protésico, necesidad de cirugía, afectación extensa, o sospecha ectima gangrenoso) Infección urinaria en lactantes<3 meses Lactantes<3 meses con cualquier infección localizada que requiera ingreso Infecciones en inmunodeprimidos y portadores de catéteres venosos |
| Grupo B. Considerar extraer en: Neumonía que requiere ingreso hospitalario Infección urinaria febril en paciente que requiera ingreso Sospecha de peritonitis/apendicitis complicada Infección área ORL complicada (mastoiditis, sospecha de absceso para/retrofaríngeo) |
| Grupo C. No extraer de rutina: IPPB superficiales no complicadas Neumonía sin criterios de ingreso Pielonefritis en niños sanos sin ingreso hospitalario |
IPPB: infecciones de piel y partes blandas; ORL: otorrinolaringológica.
Grupo A: altamente recomendable extraer HC.
Existe unanimidad en las recomendaciones sobre su obtención:
- –
Sospecha clínica de sepsis.
- –
Infecciones focales con prevalencia de bacteriemia > 10%.
- –
Pacientes con FSF con riesgo de BO > 1,5%.
Grupo B: es conveniente extraer HC:
- –
Infecciones focales con riesgo de bacteriemia 1-10%.
- –
Pacientes que requieren ingreso para tratamiento antibiótico parenteral.
- –
FSF con riesgo de BO de 0,5-1,5%.
Grupo C: no se recomienda extracción de HC de rutina:
- –
Infecciones focales con riesgo de bacteriemia < 1%.
- –
FSF con riesgo de BO < 0,5%.
- –
Lactante < 3 meses: la tasa global de BO oscila entre 2-2,2% y aumenta a 4,4% cuando se asocia a urocultivo positivo2. Actualmente, está recomendado realizar HC en todo lactante < 3 meses con FSF ≥38°C2,3.
- –
Lactantes 3-36 meses: la tasa de BO en niños de 3-36 meses con FSF > 39°C y buen estado general (BEG) oscila entre < 0,5 y 0,9%, dependiendo de la cobertura vacunal antineumocócica1,5. Un estudio realizado en nuestro país muestra diferencias en la tasa de BO según el número de dosis recibidas, siendo significativamente superior en los pacientes con ninguna o una dosis en relación a aquellos con ≥ 2 dosis5. Estos hallazgos han llevado a la inclusión de la situación vacunal antineumocócica en los protocolos de manejo del lactante febril. Otros estudios muestran tasas similares entre el grupo de no vacunados y vacunados1. No existe una posición unánime del Grupo de Expertos acerca de si la actuación debe ser diferente en función de la situación vacunal antineumocócica, aunque la mayor parte están de acuerdo con las recomendaciones expuestas en la tabla 1.
- –
Grado de temperatura: la fiebre > 40°C se ha relacionado con una mayor probabilidad de IBPG en < 3 meses; en niños mayores de esta edad la relación entre cifra de temperatura e IBPG no está clara. La duración de la fiebre o la respuesta a antitérmicos no son buenos predictores de BO y no deben cambiar el manejo del niño con FSF7.
- –
Paciente inmunodeprimido: las tasas elevadas de BO en estos pacientes hacen que sea imprescindible obtener HC.
- –
Fiebre prolongada: en pacientes con FSF > 7 días se recomienda realizar HC.
- –
Antibioterapia parenteral: en pacientes con FSF en los que se indica antibiótico parenteral se debe extraer HC previamente.
- –
Fiebre a la vuelta del trópico: en los niños con fiebre al regreso del trópico/zona endémica se recomienda extraer HC además del estudio de paludismo.
En los niños con cuadro clínico de sepsis, shock séptico o shock tóxico es obligatorio extraer HC3,8.
Indicaciones en pacientes con infecciones localizadas (tabla 2)- –
Meningitis: los HC en pacientes con sospecha de meningitis bacteriana tienen una alta rentabilidad diagnóstica y deben extraerse siempre9.
- –
Neumonía: la prevalencia de bacteriemia en niños con neumonía comunitaria es del 2,1-7%, siendo > 10% en neumonías complicadas y del 20% en empiema10. Se recomienda siempre su extracción en aquellos pacientes que precisen ingreso por su situación clínica o en que se sospeche una neumonía complicada.
- –
Infecciones de piel y partes blandas (IPPB): en un trabajo reciente sobre IPPB superficiales no complicadas ningún paciente presentó bacteriemia frente al 12,5% en las infecciones complicadas4. Por lo tanto, la extracción de HC debería limitarse a determinadas circunstancias (tabla 2).
- –
Infecciones osteoarticulares: la extracción de HC está indicada antes de iniciar el tratamiento antibiótico por su elevada rentabilidad (> 50%)11.
- –
Infecciones del tracto urinario (ITU) febriles: la tasa de bacteriemia depende de la edad, siendo de hasta el 20% en neonatos y < 5% en > 3 meses. Por lo tanto, se debe extraer HC en lactantes < 3 meses febriles con sospecha de ITU y en aquellos de mayor edad que requieran tratamiento por vía intravenosa2,12.
- –
Endocarditis (EI): su extracción está indicada en todo niño con sospecha de EI.
- –
Infecciones intraabdominales: ante la sospecha de peritonitis aguda se recomienda extraer HC, aunque su rentabilidad está poco estudiada y el cultivo del líquido peritoneal/exudado intraoperatorio es la muestra de elección.
- –
Infecciones complicadas del área ORL: en las infecciones complicadas del área ORL que requieran ingreso debe valorarse extraer HC.
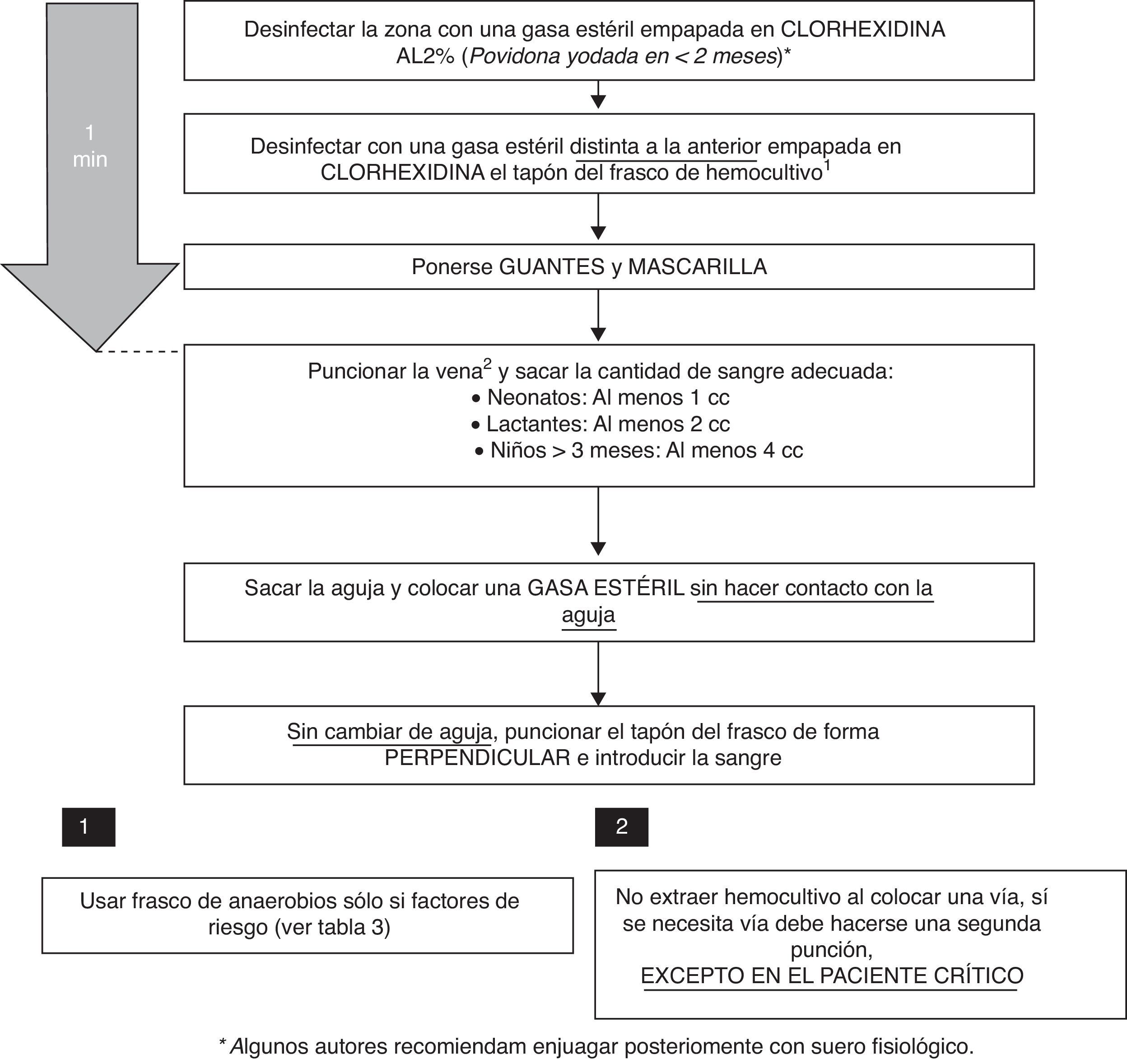
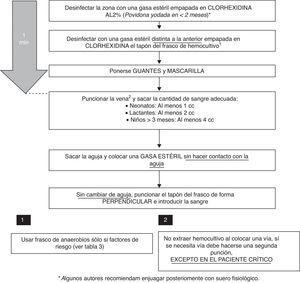
En el proceso de extracción hay varios factores que pueden determinar un mayor rendimiento de la prueba y una menor tasa de HC contaminados:
- –
Volumen de la muestra: si bien en neonatos no solo es importante el volumen de la muestra, sino también la dilución respecto al medio de cultivo13, en niños mayores el volumen supone el factor más importante para incrementar su rendimiento. Se ha descrito que por cada mililitro extra de sangre que se cultiva se incrementa la tasa de positividad un 0,6-4,7%. La inoculación de un volumen inadecuado —tanto por defecto como por exceso— supone una causa frecuente de falsos negativos del HC, habiéndose cifrado en > 50% de los casos14. En general, lo recomendado para los medios de cultivo más utilizados en pediatría es una dilución sangre-medio de cultivo de 1:5. Como la mayoría de los frascos de HC pediátricos tienen 20ml de medio, lo ideal sería extraer 4ml de sangre, aunque esta cantidad es complicada de extraer en neonatos y lactantes, por lo que se considera adecuada la extracción de 1 y 2ml de sangre, respectivamente. En caso de obtenerse ≥ 10ml de sangre deben utilizarse los frascos de adulto.
- –
Número de HC: la extracción seriada de HC en pacientes pediátricos ha mostrado ser de poca utilidad15, a excepción de en el paciente inmunodeprimido.
- –
Elección del medio de cultivo: el cultivo en medio anaerobio además del aerobio no aumenta el rendimiento de los HC, salvo en aquellos casos con factores de riesgo de bacteriemia por anaerobios16. Si se sospecha un microrganismo inusual o de difícil crecimiento debe contactarse con el laboratorio de Microbiología.
- –
Desinfección de la zona a puncionar: algunos trabajos muestran que el poder antiséptico de la clorhexidina alcohólica a concentraciones > 0,5% es mayor que el de otros productos, siendo este efecto máximo al minuto de su aplicación17,18. La clorhexidina alcohólica al 2% ha demostrado seguridad en pacientes > 2 meses de edad, no habiéndose probado su uso en menores de esta edad, en los que lo recomendable sería el uso de la povidona yodada. Algunos autores del Grupo de Expertos recomiendan enjuagar posteriormente con suero fisiológico, no existiendo en la literatura evidencia a favor ni en contra sobre este punto. Otro aspecto importante es el uso de guantes estériles para el procedimiento19.
- –
Lugar y momento de la punción: se recomienda extraer el HC preferentemente de la región antecubital y, si la situación clínica del paciente lo permite, demorar su obtención al inicio del pico febril.
- –
Técnica de extracción: no debe extraerse la muestra de un catéter ya colocado en el paciente (salvo en sospechas de infección asociada al catéter). Esta práctica ha demostrado aumentar la tasa de contaminación de los HC entre 2 y 3 veces15,20,21, por lo que debería extraerse la muestra siempre por punción con aguja, nunca con angiocatéter. Algunos autores recomiendan el uso de mascarillas desechables durante la realización del HC19,22. El momento de la extracción de la aguja suele ser otro punto crítico. Es habitual realizar compresión con un algodón en el punto de venopunción para prevenir la formación de un hematoma. En ocasiones, el gesto su colocación se realiza con tanta premura que el algodón entra en contacto con la aguja, por lo que aumenta el riesgo de contaminación. Lo recomendable sería el uso de una gasa estéril para esta función, y siempre colocándola una vez extraída la aguja.
- –
Frasco de HC: la desinfección del tapón del frasco de HC disminuye el número de muestras contaminadas. Lo que no parece tener utilidad es el cambio de aguja previo a la inoculación en el frasco, además de asociarse a pinchazos accidentales, por lo que no se recomienda23. Es importante recordar que siempre debe inocularse la sangre en el frasco de HC en primer lugar.
De acuerdo con la evidencia científica revisada, se ha elaborado un protocolo de extracción de HC con los pasos a seguir (fig. 1).
Transporte y procesamiento de los hemocultivosUna vez inoculados, los HC deben ser enviados al laboratorio lo más rápidamente posible para ser introducidos en el incubador del sistema automático. En caso que no sea posible y el transporte se demore, las botellas de HC para sistemas automáticos deben mantenerse a temperatura ambiente sin quedar expuestos a la luz solar directa y sin superar las 18 h para no afectar la viabilidad bacteriana. Actualmente, la metodología para el procesamiento de los HC está establecida y aceptada de manera general y su aplicación se realiza con un alto grado de estandarización24. El tiempo necesario para la detección de crecimiento depende del microorganismo implicado y de la concentración bacteriana del inóculo.
Cuando se detecta crecimiento en una botella de HC se realiza una tinción de Gram para determinar la morfología y, según los hallazgos, se realizan los subcultivos en los medios más indicados y el antibiograma.
Hemocultivos en situaciones especialesPacientes inmunodeprimidosExiste suficiente evidencia científica para recomendar la recogida de HC ante una T.ª ≥ 38°C, o incluso de febrícula mantenida, en los pacientes inmunodeprimidos25,26. El problema surge si se aísla un microorganismo que forma parte de la microbiota del paciente, como los estafilococos coagulasa negativos, Streptococcus del grupo viridans, Corynebacterium spp., Propionibacterium acnes, Bacillus spp. y algunas especies de Clostridium26,27. En estos casos no es fácil distinguir entre contaminación y auténtica bacteriemia. Un factor a tener en cuenta es el número de HC en que se repite el mismo aislamiento. Suponiendo que todas las extracciones no se han realizado de una misma vía contaminada, la repetición de la misma bacteria en más de un HC aumenta la probabilidad de que se trate de una bacteriemia verdadera. Por contra, la presencia de un solo HC positivo entre 2 o más extracciones seriadas en un corto período iría a favor de una contaminación26,27. En cualquier caso, no existe ningún método definitivo para diferenciar contaminación y bacteriemia verdadera, por lo que deberá ser el clínico quien decida en cada caso cómo interpretar los resultados del HC.
Pacientes portadores de catéteres vasculares centralesEn niños portadores de catéteres vasculares centrales o sistemas de port-a-cath se recomienda recoger 2 o más HC simultáneamente, al menos uno de vía central y otro por venopunción. El aislamiento de la misma bacteria en ambos HC aumenta la probabilidad de una bacteriemia verdadera, así como la recomendación terapéutica de retirar el catéter colonizado15,27. La velocidad del crecimiento bacteriano en el HC se relaciona con una mayor probabilidad de verdadera bacteriemia28.
Indicación de hemocultivo para anaerobiosSe recomienda solicitar este cultivo únicamente en situaciones de alta sospecha clínica17,29,30 (tabla 3).
Indicaciones para la recogida de HC para anaerobios
| Sepsis de origen abdominal |
| Sepsis de origen cutáneo con posible participación de anaerobios (mucositis oral severa, mordeduras, heridas por aplastamiento o úlceras sacras) |
| Sepsis nosocomial tras cirugía abdominal o traumatológica |
| Sepsis con hipotensión refractaria |
| Fiebre de origen dentario |
| Infecciones crónicas (sinusitis, osteomielitis) |
| Pacientes inmunodeprimidos |
Los HC contaminados pueden provocar ingresos innecesarios, retraso en el diagnóstico, administración de antibióticos y la práctica de nuevos HC u otras pruebas. Por todo ello, ante un HC con crecimiento bacteriano resulta esencial discriminar de forma precoz entre verdadera bacteriemia y contaminación. Se exponen los principales factores a tener en cuenta:
Microorganismo aisladoLa epidemiología de la bacteriemia está sometida a cambios constantes relacionados con el consumo de antibióticos, la vacunación, las variaciones geográficas y los microorganismos emergentes31-33. Actualmente, los microorganismos implicados con mayor frecuencia son: a) durante el periodo neonatal: Streptococcus agalactiae, Escherichia coli, Klebsiella spp. y Listeria monocytogenes, y b) a partir de los 30 días de vida S. pneumoniae, enterobacterias, Staphylococcus aureus y N. meningitidis (tabla 4). En los niños inmunodeprimidos también deben considerarse Pseudomonas aeruginosa y Candida spp. En los últimos años, el desarrollo de las técnicas de biología molecular ha contribuido a conocer nuevas etiologías, como Kingella kingae o Ureaplasma spp.31.
Principales microrganismos patógenos causantes de bacteriemia y contaminantes de hemocultivos
| Microorganismos patógenos |
| Streptococcus agalactiae |
| Streptococcus pneumoniae |
| Staphylococcus aureus |
| Neisseria meningitidis |
| Escherichia coli |
| Salmonella spp. y otras enterobacterias |
| Streptococcus pyogenes |
| Microorganismos contaminantes |
| S. epidermidis y otros estafilococos plasmocoagulasa negativos |
| Estreptococos del grupo viridans |
| Corynebacterium spp. |
| Propionibacterium spp. |
| Bacillus spp. |
| Bacilos gramnegativos no fermentadores (a excepción de P. aeruginosa) |
Las bacterias que son flora comensal de la piel constituyen los contaminantes más habitualmente responsables de resultados falsos positivos en niños sanos (tabla 4). Sin embargo, hay que tener en cuenta que pueden ser causa de infecciones nosocomiales o relacionadas con la asistencia sanitaria, especialmente en prematuros con catéteres e inmunodeprimidos con catéteres intravasculares.
Tiempo de detección de positividadCon la aparición de los sistemas automatizados se ha mejorado considerablemente la rapidez de detección de los patógenos causantes de bacteriemia. El tiempo de detección de positividad (TDP) del 95% de los mismos es < 24 h. Aunque el criterio clínico es lo que prevalece, esta rapidez en la detección del HC positivo es un factor a considerar en la toma de decisiones. En el caso de los microrganismos contaminantes el TDP es claramente superior, > 24 h en la mayoría de casos34.
En los niños con catéteres vasculares centrales, la diferencia en el tiempo de positividad entre el HC extraído de catéter y el de vena periférica (aislamiento ≥ 2 h antes en el de catéter indica que este es el origen de la bacteriemia) nos permite diagnosticar el foco de la bacteriemia. Para que el TDP diferencial sea valorable, es imprescindible que las extracciones se hagan simultáneamente y que se inocule el mismo volumen de sangre en los dos frascos de HC35. El TDP también se ha mostrado útil para distinguir entre contaminación y bacteriemia ante el crecimiento en el HC de estafilococos coagulasa negativos; un TDP ≤ 15 h generalmente indica que el microorganismo tiene valor clínico y si es ≥ 22 h sugiere contaminación36.
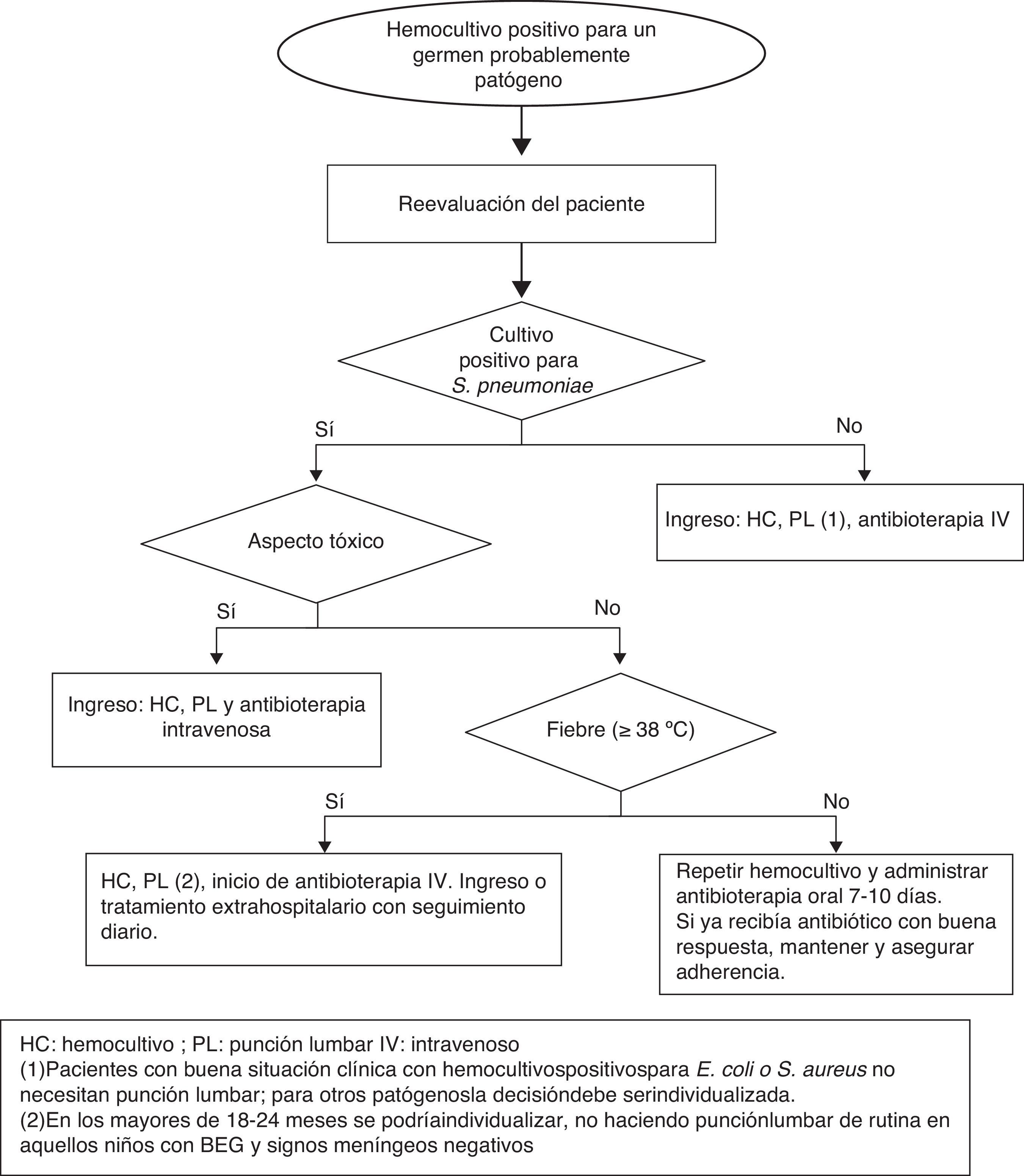
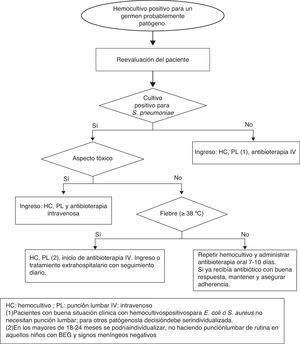
Actitud ante un hemocultivo positivo no contaminado en el niño sano con fiebre sin focoEl Servicio de Microbiología alerta habitualmente sobre la positividad de un HC a las 24-36 h de extraído o incluso antes, informando del tipo de microorganismo según la tinción de Gram. Si se extrajo en un paciente con FSF en muchas ocasiones estará en domicilio. Los pacientes con sospecha de bacteriemia verdadera deben ser reevaluados y manejados en función de la edad, situación clínica, persistencia de fiebre y tipo de microorganismo aislado37.
- –
Niños < 3 meses: se debe realizar estudio de sepsis e ingreso hospitalario administrando antibioterapia empírica según resultados microbiológicos preliminares38.
- –
Niños 3-36 meses (fig. 2):
- –
Persistencia de fiebre: si no existe foco se debe extraer nuevo HC, considerar fuertemente la realización de punción lumbar en los < 18 meses, y administrar antibioterapia parenteral. Tras su inicio, en aquellos pacientes con BEG se podría continuar la terapia antibiótica en domicilio durante 7-10 días.
- –
Paciente afebril: estos pacientes pueden ser tratados con antibioterapia por vía oral domiciliaria y seguimiento estrecho. Habrá que considerar si se debe de extraer otro HC antes del inicio de la antibioterapia, ya que el riesgo de bacteriemia persistente es del 9%39. La pauta antibiótica inicial es:
- -
Amoxicilina: 80-90mg/kg/día en 3 dosis (máximo 3 g/día).
- -
En pacientes alérgicos a penicilina se indicará tratamiento con un macrólido o cefuroxima axetilo (30mg/kg/día) si no ha habido una reacción anafiláctica grave.
- -
Si ya se había iniciado antibioterapia adecuada se mantendrá, individualizando la indicación de un nuevo HC. En todos los casos se realizará un seguimiento estrecho durante 7-10 días por pediatra de Atención Primaria.
Bacteriemia por otros patógenosLos estudios publicados sobre bacteriemia causada por organismos diferentes a S. pneumoniae sugieren que la administración de antibioterapia por vía oral no previene la infección bacteriana grave ni siquiera en niños afebriles con BEG. Además el riesgo de meningitis es superior en pacientes con bacteriemia por N. meningitidis. Por este motivo, es necesario el ingreso hospitalario en pacientes con un HC positivo para N. meningitidis, Hib, S. aureus, gramnegativos u otros patógenos. Además de a los pacientes con signos clínicos de meningitis, se recomienda realizar punción lumbar a los pacientes con HC positivo para N. meningitidis y a los lactantes de 3-6 meses con bacteriemia por Streptococcus del grupo B. Sin embargo, los niños con BEG >3 meses de edad con cultivos positivos para E. coli o S. aureus no precisan punción lumbar de manera rutinaria.
- –
Duración del tratamiento antibiótico: hasta el resultado del antibiograma se instaurará antibioterapia según la sospecha diagnóstica y la sensibilidad del microorganismo en cada medio. La duración recomendada es de 7-10 días para las bacteriemias no complicadas y el habitual si encontramos foco.
- –
Indicaciones de extracción de HC de control: el beneficio de los HC de control para establecer la curación microbiológica de la bacteriemia no se ha demostrado40. Se recomiendan realizar a las 48-96 h del inicio del tratamiento antibiótico en los siguientes casos:
- -
Bacteriemia por S. aureus (especialmente si MRSA) o bacilos gramnegativos multirresistentes.
- -
Candidemia.
- -
Persistencia fiebre o falta de respuesta clínica después de 48-96 h de tratamiento antibiótico apropiado.
- -
Reaparición de fiebre.
- -
Sospecha de EI.
- -
Los autores declaran no tener ningún conflicto de intereses.