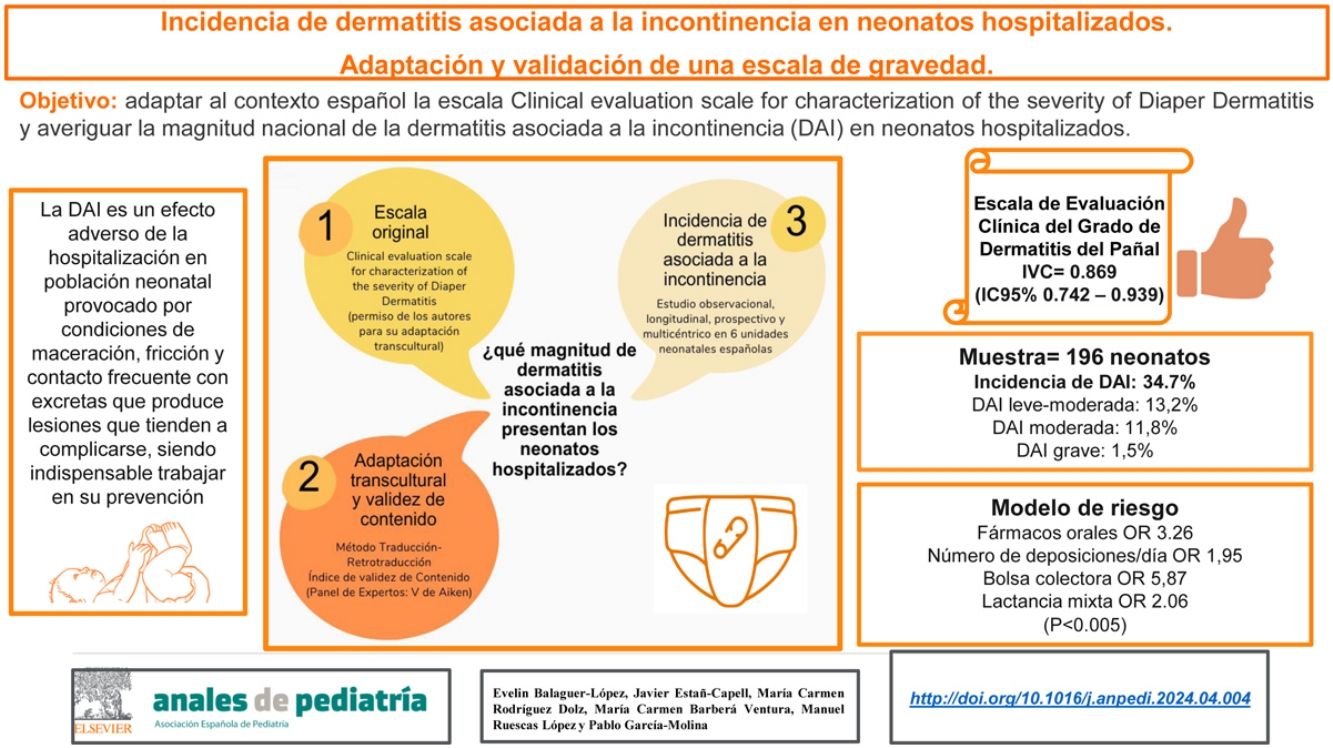
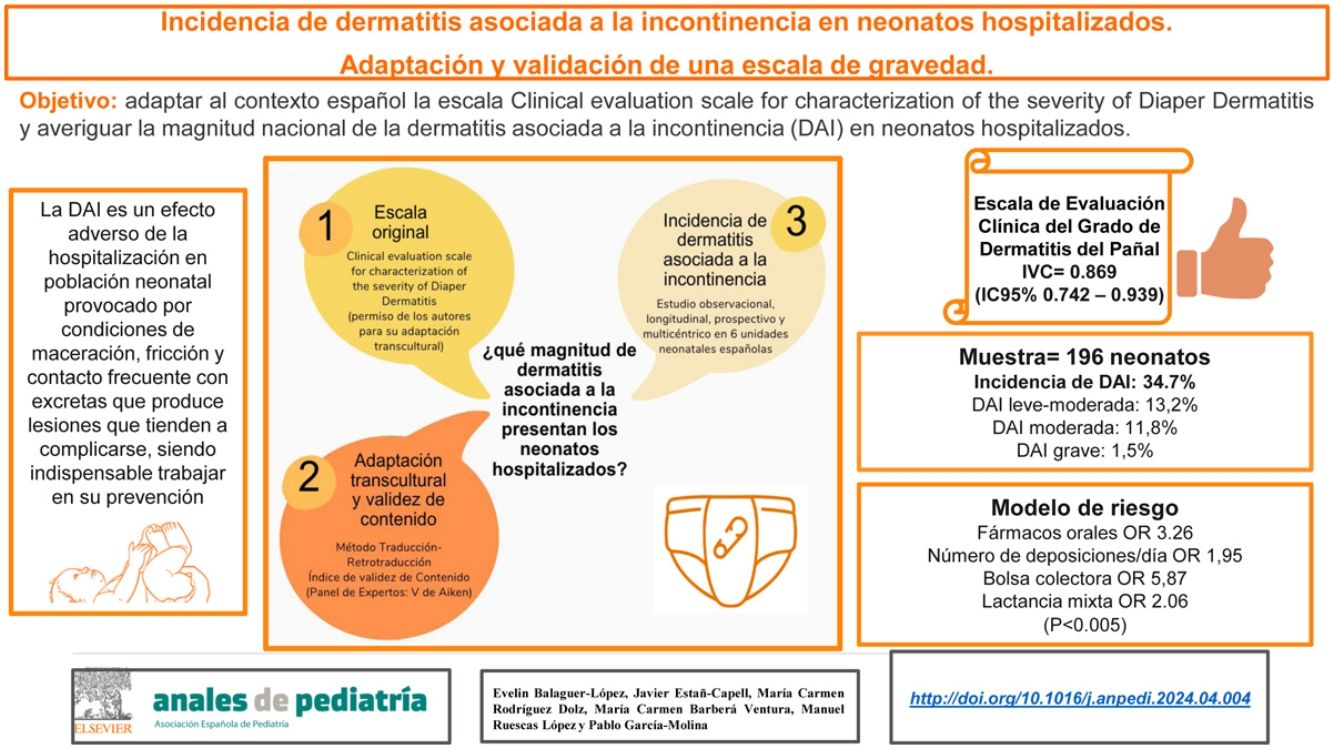
Hasta el 60% de los neonatos hospitalizados pueden desarrollar una dermatitis asociada a la incontinencia (DAI). El objetivo fue adaptar al contexto español la escala Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis y averiguar la magnitud nacional de la DAI en neonatos hospitalizados.
MetodologíaAdaptación transcultural y validez de contenido. Estudio observacional, prospectivo y multicéntrico de incidencia de dermatitis del pañal en unidades de hospitalización y cuidados intensivos neonatales de 6 hospitales españoles.
ResultadosSe obtuvo un índice de validez de contenido de 0,869 para el total de la escala (IC95%: 0,742-0,939). Se incluyen un total de 196 neonatos. Se obtuvo una incidencia acumulada de DAI del 32,1% (9,1% leves-moderadas, 8% moderadas y 1,6% graves). La tasa de incidencia fue de 2,2 DAI por cada 100 neonatos/día de ingreso. El pH de las heces <5,5, el número de deposiciones/día, los mililitros de orina/día y los fármacos orales fueron algunos de los factores favorecedores de DAI.
ConclusionesLa versión española de la Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis tiene un contenido válido para valorar DAI en población neonatal ingresada. Los neonatos portadores de lactancia mixta, fármacos orales y dispositivos locales en la zona perianal tienen más riesgo de presentar dermatitis del pañal.
Up to 60% of hospitalised neonates may develop incontinence-associated dermatitis (IAD). Our aim was to adapt the Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis to the Spanish population and to find out the nationwide frequency of IAD in hospitalized neonates.
MethodsCross-cultural adaptation and assessment of content validity of the scale. We carried out a prospective, multicentre observational study of the incidence of nappy rash in postnatal wards and neonatal intensive care units in 6 Spanish hospitals.
ResultsWe obtained a content validity index of 0.869 for the total scale (95%CI: 0.742-0.939). The sample included 196 neonates. The cumulative incidence of IAD was 32.1% (9.1% mild-moderate, 8% moderate and 1.6% severe). The incidence rate was 2.2 IAD cases per 100 patient days. A stool pH of less than 5.5, a greater number of bowel movements a day, a greater daily urine output and the use of oral drugs were among the factors associated with the development of IAD.
ConclusionThe Spanish version of the Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis had an adequate content validity for the assessment of DAI in the hospitalised neonatal population. Mixed feeding, treatment with oral drugs and the use of medical devices in the perianal area were associated with an increased risk of nappy dermatitis in infants.
La dermatitis asociada a la incontinencia (DAI) o dermatitis del pañal (DP) del recién nacido es una lesión irritante inflamatoria que se manifiesta en la zona cubierta por el pañal o zonas adyacentes1. Esta dermatitis irritativa es un serio problema que se produce debido a las especiales condiciones de humedad, maceración, fricción y contacto con la orina, heces y otras sustancias durante la etapa neonatal1,2.
La aparición de la DP se atribuye a una disfunción de la barrera de la piel, además de la propia irritación3. La acción de irritantes externos (heces, orina, material de los pañales, humedad, fricción)4,5 y de factores internos (cambios en el pH dérmico, excesivas pérdidas de agua transepidérmica, excesiva hidratación de la piel, hipozinquemia)3,6 favorece la aparición de lesiones, que tienden a complicarse por acción de los microorganismos presentes en la zona5,7,8.
La incidencia comunitaria de DAI en población neonatal se estima entre el 25% y el 70%9-12. En neonatos hospitalizados la incidencia también varían ampliamente entre estudios, del 4,7% hasta el 60%13-17.
La variabilidad en los estudios no se observa únicamente en los resultados, también entre los diferentes métodos de valoración de DAI aplicados (juicio clínico de dermatólogos, juicio clínico de profesionales sanitarios o aplicación de escalas estandarizadas de valoración)13-17. Stamatas et al. recomendaron la utilización de escalas de clasificación de gravedad de DAI específicas para población infantil, en lugar de las escalas utilizadas en la bibliografía científica habitual diseñadas para población adulta18,19.
La DAI es un evento adverso nosocomial frecuente en el neonato, siendo necesario cuantificar la magnitud del problema y evaluar los mejores métodos de valoración clínica y prevención10,19. Ante la falta de estudios epidemiológicos multicéntricos y herramientas de valoración de la DAI validadas en nuestro contexto sanitario para la población pediátrica y neonatal, quisimos adaptar la herramienta recomendada por Stamatas et al. y averiguar la magnitud nacional de la DAI en neonatos hospitalizados, así como evaluar los factores de riesgo y las medidas preventivas relacionadas con su aparición.
MetodologíaAdaptación transcultural de la Clinical Evaluation Scale for Characterization of the Severity of Diaper DermatitisTras recibir el permiso de los autores de la escala original18, se realizó la adaptación transcultural mediante el método de traducción y retrotraducción llevadas a cabo por dos empresas de traducción independientes. Los miembros del equipo investigador elaboraron una versión consensuada de la escala sobre la que no se añade ningún concepto no presente en las traducciones. Posteriormente, la versión consensuada se envió a retrotraducir por dos traductores bilingües, valorándose la equivalencia de los ítems con la versión original.
Validez de contenido de la Clinical Evaluation Scale for Characterization of the Severity of Diaper DermatitisLa validez de contenido se llevó a cabo mediante el cálculo del índice de validez de contenido (IVC) a través de las valoraciones de cada ítem de la escala mediante 4 criterios: ambigüedad, sencillez, claridad y relevancia. Cada criterio estuvo estratificado mediante una escala Likert de 1 a 4. Las valoraciones fueron realizadas por un panel de 15 expertos20 designados en base al método Fehring21 adaptado (ser profesional de la salud con la especialidad de pediatría [3 puntos], poseer un máster y/o doctorado [1 punto], haber desarrollado una tesis relevante para el tema de estudio [2 puntos], haber publicado algún artículo relevante para el tema tratado en una revista con revisores [2 puntos], pertenecer a un grupo de investigación reconocido o tener experiencia en investigación relevante para el tema tratado [2 puntos], poseer experiencia clínica de al menos 5años en pediatría [2 puntos] o poseer experiencia mínima de un año en el área de neonatología [2 puntos]). Para ser considerado experto se precisó una puntuación mínima de 5puntos. La consulta se hizo a través de una invitación por correo electrónico a todos los expertos, incluyendo un enlace al cuestionario online (software package LimeSurvey; http://limesurvey.org).
Incidencia de dermatitis del pañalEstudio observacional, prospectivo y multicéntrico de incidencia de DP llevado a cabo en seis unidades neonatales españolas (Hospital Clínico de Valencia, Hospital Clínico San Carlos de Madrid, Hospital General Universitario de Valencia, Hospital Fundación Jiménez Díaz de Madrid, Hospital Son Llàtzer de Palma de Mallorca y Hospital San Pedro de Logroño) durante los meses de marzo a julio de 2016. Se excluyeron estancias inferiores a 72horas, neonatos que ya fueran portadores de DAI o lesiones en la zona perianal y neonatos con patologías dérmicas diagnosticadas. Para la clasificación de DAI se utilizó la versión en castellano de la Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis, considerando paciente «con dermatitis» aquel que presentaba como mínimo un grado «ligero» de lesión.
Tamaño muestral y análisis estadísticoPara la determinación del IVC se aplicó la V de Aiken, considerando contenido adecuado puntuaciones iguales o superiores a 0,7520. Para el análisis de los intervalos de confianza de la V de Aiken se usó un programa informático de libre distribución desarrollado con el programa Visual Basic 6.0 (Microsoft®, Washington)22.
Para el tamaño de la muestra del estudio de incidencia se asumió una proporción esperada de DP del 0,3, un nivel de confianza del 95%, una precisión de 0,08 y un 10% de pérdidas, obteniendo una muestra de 140 sujetos, repartida entre los seis hospitales según número de ingresos.
Se realizó un análisis descriptivo de la muestra y se estimó la incidencia acumulada y la tasa de incidencia de DAI. Se aplicó chi-cuadrado (F exacta de Fisher) y la t de Student (U de Mann-Whitney) y ANOVA de un factor (post hoc Bonferroni para varianzas iguales y Games-Howell para varianzas diferentes) para establecer diferencias significativas entre posibles variables explicativas de la presencia de DAI. En las variables que resultaron significativas se calculó la OR para determinar en qué grado actúan dichas variables como factor de riesgo/prevención de DAI. Finalmente, se estimó un modelo en regresión logística con las variables que presentaban diferencias significativas. Los datos fueron tabulados y analizados mediante el paquete estadístico SPSS versión 21.0 (2012. Armonk, NY: IBM Corp.). El nivel de significación se estableció en 0,05.
Control de sesgosLa homogeneización en la recogida de datos se aseguró mediante sesiones de formación en el manejo de la versión en castellano de la Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis. A su vez, se adiestró en la recogida de datos a todas/os los profesionales de las unidades neonatales participantes. Los materiales audiovisuales para la formación fueron alojados en la página web <www.upppediatria.org>.
ResultadosAdaptación transcultural y validez de contenido de la Clinical Evaluation Scale for Characterization of the Severity of Diaper DermatitisTras el proceso de traducción y retrotraducción se obtuvo la versión definitiva en castellano de la escala (material suplementario).
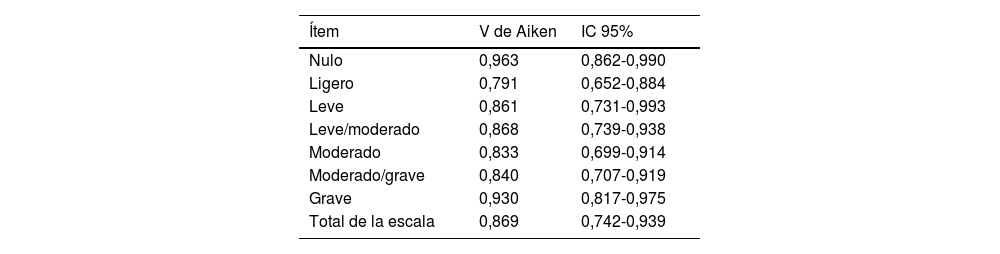
Esta versión se sometió al proceso de validación de contenido, por un panel de 15 expertos. Tras el análisis de los datos se obtuvo un valor de 0,869 para el total de la escala (IC95%: 0,742-0,939), considerándose todos los ítems válidos (tabla 1).
IVC versión en castellano de la escala Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis
| Ítem | V de Aiken | IC 95% |
|---|---|---|
| Nulo | 0,963 | 0,862-0,990 |
| Ligero | 0,791 | 0,652-0,884 |
| Leve | 0,861 | 0,731-0,993 |
| Leve/moderado | 0,868 | 0,739-0,938 |
| Moderado | 0,833 | 0,699-0,914 |
| Moderado/grave | 0,840 | 0,707-0,919 |
| Grave | 0,930 | 0,817-0,975 |
| Total de la escala | 0,869 | 0,742-0,939 |
IC 95%: intervalo de confianza al 95%.
Se incluyen un total de 196 neonatos. El 53,6% fueron varones, el 81,1% de raza caucásica, el 57,7% pretérmino y el 51,5% presentaron parto distócico.
Los trastornos perinatales supusieron el 55,1% de los diagnósticos principales de la muestra, seguido por procesos endocrino-nutricionales (12,8%).
Incidencia de dermatitis del pañalSe obtuvo una incidencia acumulada de DAI del 34,7%. La tasa de incidencia fue de 2,9 DAI por cada 100 neonatos/día de ingreso. La media de días de ingreso hasta el primer episodio de dermatitis fue de 10,3 [±10].
La Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis mostró un 13,2% leves-moderadas, un 11,8% moderadas y un 1,5% de DAI grave. El 70,6% de las DAI afectaron a la zona perianal, el 8,8% a las nalgas y el 7,4% a las ingles. Se valoró la presencia de infección local en los neonatos con DAI, no aislando patógenos en el 82,4% de los episodios y detectando patógenos bacterianos en el 17,6% restante. En ningún neonato se aislaron patógenos fúngicos.
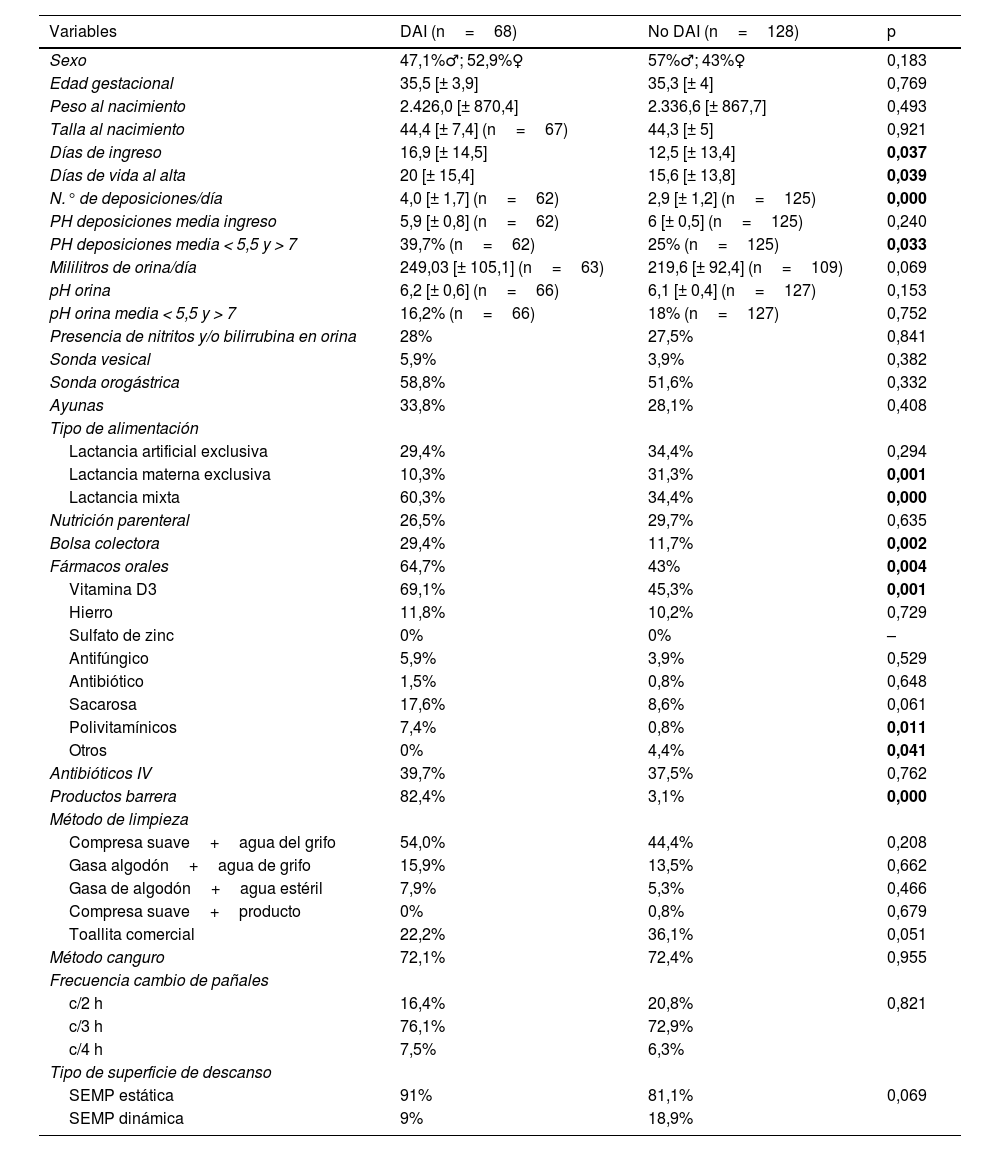
La descripción de la muestra respecto a la presencia o no de DAI puede verse en la tabla 2.
Descripción de la muestra respecto a la presencia/ausencia de DAI
| Variables | DAI (n=68) | No DAI (n=128) | p |
|---|---|---|---|
| Sexo | 47,1%♂; 52,9%♀ | 57%♂; 43%♀ | 0,183 |
| Edad gestacional | 35,5 [± 3,9] | 35,3 [± 4] | 0,769 |
| Peso al nacimiento | 2.426,0 [± 870,4] | 2.336,6 [± 867,7] | 0,493 |
| Talla al nacimiento | 44,4 [± 7,4] (n=67) | 44,3 [± 5] | 0,921 |
| Días de ingreso | 16,9 [± 14,5] | 12,5 [± 13,4] | 0,037 |
| Días de vida al alta | 20 [± 15,4] | 15,6 [± 13,8] | 0,039 |
| N.° de deposiciones/día | 4,0 [± 1,7] (n=62) | 2,9 [± 1,2] (n=125) | 0,000 |
| PH deposiciones media ingreso | 5,9 [± 0,8] (n=62) | 6 [± 0,5] (n=125) | 0,240 |
| PH deposiciones media < 5,5 y > 7 | 39,7% (n=62) | 25% (n=125) | 0,033 |
| Mililitros de orina/día | 249,03 [± 105,1] (n=63) | 219,6 [± 92,4] (n=109) | 0,069 |
| pH orina | 6,2 [± 0,6] (n=66) | 6,1 [± 0,4] (n=127) | 0,153 |
| pH orina media < 5,5 y > 7 | 16,2% (n=66) | 18% (n=127) | 0,752 |
| Presencia de nitritos y/o bilirrubina en orina | 28% | 27,5% | 0,841 |
| Sonda vesical | 5,9% | 3,9% | 0,382 |
| Sonda orogástrica | 58,8% | 51,6% | 0,332 |
| Ayunas | 33,8% | 28,1% | 0,408 |
| Tipo de alimentación | |||
| Lactancia artificial exclusiva | 29,4% | 34,4% | 0,294 |
| Lactancia materna exclusiva | 10,3% | 31,3% | 0,001 |
| Lactancia mixta | 60,3% | 34,4% | 0,000 |
| Nutrición parenteral | 26,5% | 29,7% | 0,635 |
| Bolsa colectora | 29,4% | 11,7% | 0,002 |
| Fármacos orales | 64,7% | 43% | 0,004 |
| Vitamina D3 | 69,1% | 45,3% | 0,001 |
| Hierro | 11,8% | 10,2% | 0,729 |
| Sulfato de zinc | 0% | 0% | – |
| Antifúngico | 5,9% | 3,9% | 0,529 |
| Antibiótico | 1,5% | 0,8% | 0,648 |
| Sacarosa | 17,6% | 8,6% | 0,061 |
| Polivitamínicos | 7,4% | 0,8% | 0,011 |
| Otros | 0% | 4,4% | 0,041 |
| Antibióticos IV | 39,7% | 37,5% | 0,762 |
| Productos barrera | 82,4% | 3,1% | 0,000 |
| Método de limpieza | |||
| Compresa suave+agua del grifo | 54,0% | 44,4% | 0,208 |
| Gasa algodón+agua de grifo | 15,9% | 13,5% | 0,662 |
| Gasa de algodón+agua estéril | 7,9% | 5,3% | 0,466 |
| Compresa suave+producto | 0% | 0,8% | 0,679 |
| Toallita comercial | 22,2% | 36,1% | 0,051 |
| Método canguro | 72,1% | 72,4% | 0,955 |
| Frecuencia cambio de pañales | |||
| c/2 h | 16,4% | 20,8% | 0,821 |
| c/3 h | 76,1% | 72,9% | |
| c/4 h | 7,5% | 6,3% | |
| Tipo de superficie de descanso | |||
| SEMP estática | 91% | 81,1% | 0,069 |
| SEMP dinámica | 9% | 18,9% |
♀: mujer; ♂: hombre; ±: desviación típica de la media; c: cada; p: significación.
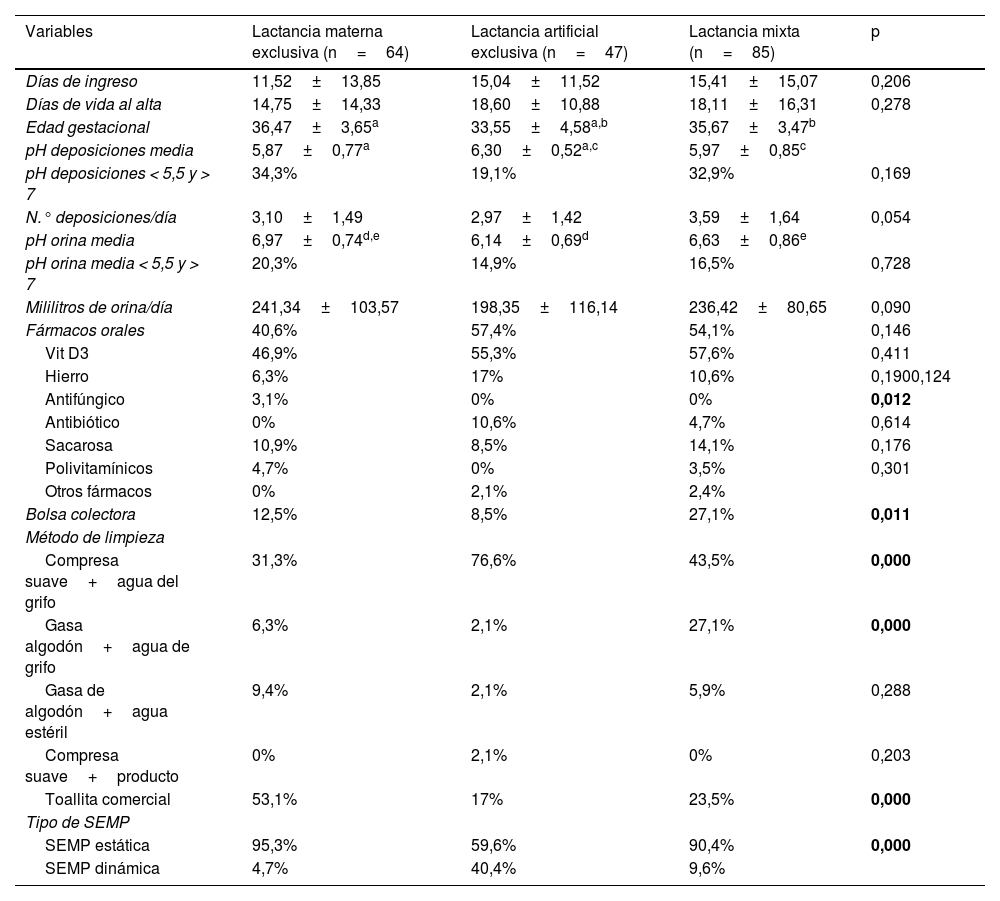
En base a la relación de protección de la lactancia materna, así como la relación de riesgo de la lactancia mixta con respecto a la DAI, se plantea la descripción de la muestra y su análisis en base al tipo de alimentación recibida durante el ingreso (tabla 3).
Descripción de la muestra por tipo de alimentación respecto a la presencia de DAI
| Variables | Lactancia materna exclusiva (n=64) | Lactancia artificial exclusiva (n=47) | Lactancia mixta (n=85) | p |
|---|---|---|---|---|
| Días de ingreso | 11,52±13,85 | 15,04±11,52 | 15,41±15,07 | 0,206 |
| Días de vida al alta | 14,75±14,33 | 18,60±10,88 | 18,11±16,31 | 0,278 |
| Edad gestacional | 36,47±3,65a | 33,55±4,58a,b | 35,67±3,47b | |
| pH deposiciones media | 5,87±0,77a | 6,30±0,52a,c | 5,97±0,85c | |
| pH deposiciones < 5,5 y > 7 | 34,3% | 19,1% | 32,9% | 0,169 |
| N.° deposiciones/día | 3,10±1,49 | 2,97±1,42 | 3,59±1,64 | 0,054 |
| pH orina media | 6,97±0,74d,e | 6,14±0,69d | 6,63±0,86e | |
| pH orina media < 5,5 y > 7 | 20,3% | 14,9% | 16,5% | 0,728 |
| Mililitros de orina/día | 241,34±103,57 | 198,35±116,14 | 236,42±80,65 | 0,090 |
| Fármacos orales | 40,6% | 57,4% | 54,1% | 0,146 |
| Vit D3 | 46,9% | 55,3% | 57,6% | 0,411 |
| Hierro | 6,3% | 17% | 10,6% | 0,1900,124 |
| Antifúngico | 3,1% | 0% | 0% | 0,012 |
| Antibiótico | 0% | 10,6% | 4,7% | 0,614 |
| Sacarosa | 10,9% | 8,5% | 14,1% | 0,176 |
| Polivitamínicos | 4,7% | 0% | 3,5% | 0,301 |
| Otros fármacos | 0% | 2,1% | 2,4% | |
| Bolsa colectora | 12,5% | 8,5% | 27,1% | 0,011 |
| Método de limpieza | ||||
| Compresa suave+agua del grifo | 31,3% | 76,6% | 43,5% | 0,000 |
| Gasa algodón+agua de grifo | 6,3% | 2,1% | 27,1% | 0,000 |
| Gasa de algodón+agua estéril | 9,4% | 2,1% | 5,9% | 0,288 |
| Compresa suave+producto | 0% | 2,1% | 0% | 0,203 |
| Toallita comercial | 53,1% | 17% | 23,5% | 0,000 |
| Tipo de SEMP | ||||
| SEMP estática | 95,3% | 59,6% | 90,4% | 0,000 |
| SEMP dinámica | 4,7% | 40,4% | 9,6% |
0,043.
a,b,c,d,e: significación post hoc ANOVA (Bonferroni / Games-Howell); p: significación.
Lactancia materna exclusiva: solo reciben lactancia materna durante el ingreso; lactancia artificial exclusiva: solo reciben lactancia artificial durante el ingreso; lactancia mixta: durante el ingreso reciben en algún momento lactancia materna y lactancia artificial.
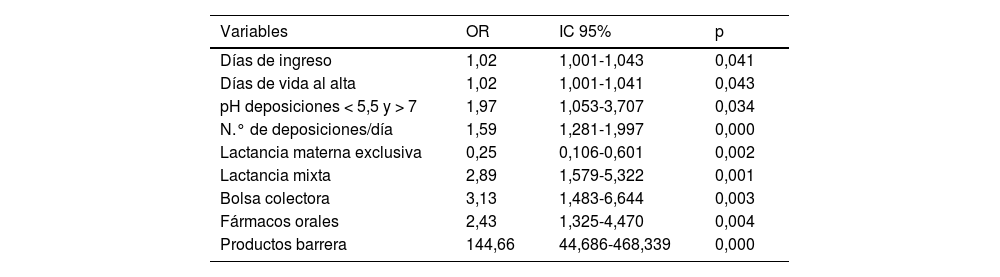
La relación de riesgo de las variables significativas y la presencia de DAI se puede observar en la tabla 4.
Odds ratio de presencia de DAI en relación a variables significativas
| Variables | OR | IC 95% | p |
|---|---|---|---|
| Días de ingreso | 1,02 | 1,001-1,043 | 0,041 |
| Días de vida al alta | 1,02 | 1,001-1,041 | 0,043 |
| pH deposiciones < 5,5 y > 7 | 1,97 | 1,053-3,707 | 0,034 |
| N.° de deposiciones/día | 1,59 | 1,281-1,997 | 0,000 |
| Lactancia materna exclusiva | 0,25 | 0,106-0,601 | 0,002 |
| Lactancia mixta | 2,89 | 1,579-5,322 | 0,001 |
| Bolsa colectora | 3,13 | 1,483-6,644 | 0,003 |
| Fármacos orales | 2,43 | 1,325-4,470 | 0,004 |
| Productos barrera | 144,66 | 44,686-468,339 | 0,000 |
IC 95%: intervalo de confianza al 95%; OR: odds ratio; p: significación.
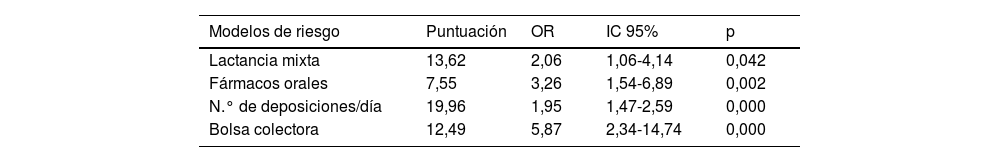
Se diseña un modelo de riesgo de DAI neonatal que explica el 50% de riesgo observado (tabla 5).
Modelo de riesgo de DAI neonatal
| Modelos de riesgo | Puntuación | OR | IC 95% | p |
|---|---|---|---|---|
| Lactancia mixta | 13,62 | 2,06 | 1,06-4,14 | 0,042 |
| Fármacos orales | 7,55 | 3,26 | 1,54-6,89 | 0,002 |
| N.° de deposiciones/día | 19,96 | 1,95 | 1,47-2,59 | 0,000 |
| Bolsa colectora | 12,49 | 5,87 | 2,34-14,74 | 0,000 |
IC 95%: intervalo de confianza al 95%; OR: odds ratio; p: significación.
Se planteó un estudio de adaptación transcultural y validez de contenido de la escala de gravedad de dermatitis Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis18, obteniendo su versión en castellano, cuyo contenido se considera válido para clasificar la DP en la población neonatal española. Una revisión bibliográfica llevada a cabo por Dunk et al.19 en 2022 detectó hasta ocho herramientas de evaluación de DP en población infantil en los diferentes estudios, lo que genera diversidad de criterios y dificultad a la hora de establecer relaciones entre estudios23. En el contexto español, la Clinical Evaluation Scale for Characterization of the Severity of Diaper Dermatitis es la primera escala validada para la población neonatal. Esser y Dunk concluyeron, tras sus revisiones, que contar con escalas validadas permitiría aunar criterios, dimensionar la DAI, determinar su nivel de gravedad y valorar la evolución en el plan de cuidados19,23. La variabilidad de herramientas con el mismo fin, validadas en distintos países y aplicables a distintas poblaciones etarias, hace compleja la universalización de los resultados en investigación. Proyectos internacionales como Ghent Global Incontinence Associated Dermatitis (IAD) Categorization Tool (GLOBIAD), validada en 30 países para población adulta, deberían ser el futuro de los procesos de validación. La utilización de una sola escala, modificada, adaptada y validada en población adulta e infantil facilitaría su aplicación clínica, homogeneizando los criterios diagnósticos y gestionando de forma efectiva los recursos preventivos en los centros sanitarios24,25.
Aplicando la escala de gravedad de la dermatitis de forma multicéntrica obtuvimos que 3 de cada 10 neonatos ingresados presentaban algún grado de DAI. Los estudios en neonatos hospitalizados muestran incidencias variables. Los estudios de Meszes et al.16 y Csoma et al.15, en los que la valoración de la dermatitis la realizó un dermatólogo, mostraban una incidencia del 4,7% (n=211) y el 5,4% (n=460), respectivamente. Visscher et al.14, en un estudio donde la valoración se realizó por enfermeras mediante el uso de escalas numéricas estandarizadas de eritema y sequedad y medidas fisiológicas, muestra cifras de incidencia del 60% (n=130). Alonso et al.13 determinaron una incidencia del 19,7% (n=213) en base a la valoración de pediatras y el uso de la escala propuesta por Lane y Drost y modificada por Kiechl-Kohlendorfer. Malik et al.17 realizan un estudio retrospectivo sobre 1.241 neonatos ingresados, obteniendo un 23% de incidencia de DP registradas en la historia clínica. La variabilidad de los modelos de valoración hace difícilmente comparable nuestros resultados con los demás estudios. El elevado porcentaje de valoraciones leves (71,4%) podría no ser considerado como DAI por un juicio clínico. Consideramos necesaria la detección precoz de este tipo de lesiones en la práctica clínica, pues, como se ha podido observar en nuestros resultados, medidas preventivas como son los productos barrera (productos con óxido de zinc, productos de silicona o poliuretano, productos con ácidos grasos, etc.) actúan como factor de riesgo en nuestro análisis porque no se aplican hasta que no se detecta la lesión.
Con respecto a los factores relacionados con la DAI en nuestro estudio, ni la edad gestacional, ni el sexo ni el peso al nacimiento tuvieron relación estadísticamente significativa. Estos resultados van en consonancia a los obtenidos en otros estudios, donde la fragilidad de la piel del prematuro no parece ser un factor que se relacione con un aumento de DAI, siendo los grupos de más semanas de vida los que más episodios de eritema presentaban13,14,26. En nuestro caso, tanto los días de ingreso como la edad cronológica al alta fueron significativamente mayores en el grupo DAI. Esta relación entre más semanas de vida y más episodios de DAI se relaciona en la bibliografía con el aumento del número de deposiciones y orina13,14,26, que en nuestro estudio también son significativamente mayores en el grupo DAI.
Con respecto al pH, no se obtuvieron diferencias significativas en la media (cuantitativa) de pH de las heces o la orina durante el ingreso entre grupos. Otros estudios han valorado el pH de la piel que cubre el pañal14,26,27, encontrando que un pH más alcalino se relaciona con aparición de DAI. Al obtener un pH medio de ingreso tanto de heces como de orina en torno a 6, consideramos explorar cuántos neonatos obtuvieron medias 0,5 a 1 punto por encima o por debajo de este pH, obteniendo que un porcentaje significativo de neonatos con dermatitis presentaba pH <5,5 y >7 en sus heces. Es probable que las lesiones cutáneas dependan más de fluctuaciones significativas tanto ácidas como alcalinas de las excretas. No encontramos esta relación de pH y DAI en el caso de la orina, lo que nos hace pensar que el irritante que actúa sobre el pH de las heces no lo hace sobre el pH de la orina.
Al analizar la relación entre tratamiento y presencia de dermatitis, se evidenció un aumento de riesgo en neonatos con tratamientos orales (suplementos nutricionales, antibioterapia, antifúngico, etc.). Si bien la relación entre antibióticos y presencia de dermatitis ha sido planteada con anterioridad por otros autores28, nuestros resultados amplían esta relación a otros tipos de fármacos orales. Cualquier fármaco oral puede observarse con más frecuencia en los neonatos con DAI. La significativa presencia de DAI observada en los neonatos suplementados con vitaminaD puede estar distorsionada por la acción de la edad, dado que los días de vida al alta de los neonatos suplementados con vitaminaD (22,2días) fue significativamente mayor (p=0,000) que los días de vida al alta de los neonatos no suplementados con vitaminaD (11,16días).
Se valoró el tipo de alimentación de los neonatos, resultando significativamente mayor el número de niños con dermatitis en los alimentados con lactancia mixta y significativamente menor en los alimentados con lactancia materna exclusiva. En esta línea, el estudio de Ersoy-Evans et al.29 obtuvo sobre una muestra de 63 niños comunitarios de entre 0 y 24meses de vida, con distintos grados de dermatitis, que los niños que habían sido alimentados con lactancia materna presentaron menos episodios de dermatitis previas. Los autores justifican este hecho con el menor pH de las heces (pH lactancia materna =5,28 /pH lactancia artificial =6,82) y la menor actividad de las lipasas y proteasas de la lactancia materna29 descrito en el estudio de Berg et al.6, llevado a cabo sobre muestras congeladas de 20 lactantes comunitarios de 1 a 5meses de edad, 10 de los cuales fueron amamantados con lactancia materna exclusiva. En nuestro estudio se realizó la media del pH de la orina y las heces de todos los días de ingreso en el momento de la excreta, observando que las heces de los neonatos alimentados con lactancia materna exclusiva presentaban un pH significativamente menor. Sin embargo, presentaban un pH significativamente mayor en la orina. Por otro lado, la lactancia mixta, claro factor de riesgo en nuestro estudio, no presentó diferencias significativas en pH de heces con la lactancia materna exclusiva. El rango etario, el tamaño de las muestras y las condiciones contextuales de los estudios de Ersoy-Evans et al.29 y Berg et al.6 difieren en gran medida de nuestro estudio, hecho que podría justificar las diferencias observadas. Buscamos posibles diferencias significativas entre lactancias en nuestra muestra, encontrando un pH de orina más alcalino en lactancia materna exclusiva y un mayor porcentaje de niños que había utilizado bolsas colectoras durante el ingreso en los alimentados con lactancia mixta. A nuestro entender, factores importantes, pero insuficientes para justificar el comportamiento protector y de riesgo de los diferentes modelos de alimentación. A día de hoy no existe una clara evidencia que relacione la introducción precoz de lactancia artificial o la lactancia mixta con otros problemas de la piel, como la dermatitis atópica30,31. Habría que considerar si los ya conocidos cambios que se producen en la microbiota en función del tipo de alimentación (diferente concentración de ácidos de cadena corta y diferentes colonias bacterianas)32-34 podrían tener relación con nuestros resultados.
ConclusionesConforme los neonatos avanzan en su desarrollo, se produce un aumento en el número de deposiciones y micciones que incrementa el riesgo de DAI derivado de un aumento de exposición a irritantes.
Los neonatos ingresados en unidades de cuidados intensivos neonatales y/u hospitalización neonatal que presenten un aumento en el número de deposiciones, sean portadores de lactancia mixta, consuman fármacos orales y sean portadores de dispositivos locales en la zona perianal (bolsas colectoras), tienen un elevado riesgo de presentar dermatitis del pañal, siendo recomendable la utilización de productos barrera de forma preventiva.
Por otro lado, los productos barrera se aplican con más frecuencia una vez detectada la lesión en la piel que de forma preventiva. La utilización de escalas de valoración clínica de dermatitis puede favorecer la detección de la DAI en estadios tempranos y anticipar el uso de productos que impidan la progresión de las lesiones a estadios más graves.
FinanciaciónLa presente investigación no ha recibido ayudas específicas de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasEl estudio fue presentado y aceptado por el Comité Ético de Investigación Clínica de cada hospital participante. A los padres/tutores se les facilitó una hoja de información y se les solicitó la firma del consentimiento informado (revocable en cualquier momento del estudio). En ningún caso se incluyeron datos que pudieran identificar directa o indirectamente al paciente según la según la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. Los investigadores de los centros participantes son garantes de la seguridad de las bases de datos, sin otro fin que el señalado como objetivo del estudio.
El protocolo de estudio fue enviado a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), siendo clasificado como «Estudio Observacional No Posautorización» (No-EPA).
Conflicto de interesesLos autores no tienen conflicto de intereses que declarar.