Desde hace más de una década, los casos complicados de neumonía adquirida en la comunidad, fundamentalmente con empiema pleural o formas necrosantes, comenzaron a ser más frecuentes en niños, según la amplia documentación procedente de numerosos países. El abordaje terapéutico óptimo de estos casos, tanto desde el punto de vista médico (antibióticos, fibrinolíticos) como técnico-quirúrgico, (drenaje pleural, videotoracoscopia) continúa siendo controvertido. En este documento, la Sociedad Española de Infectología Pediátrica y la Sociedad Española de Neumología Pediátrica revisan la evidencia científica y proponen unas pautas consensuadas de tratamiento de estos casos, fundamentalmente para el abordaje del derrame pleural paraneumónico en niños, así como la actuación en situaciones especiales, sobre todo en la cada vez más frecuente población pediátrica con enfermedades de base o inmumodepresión.
The incidence of community-acquired pneumonia complications has increased during the last decade. According to the records from several countries, empyema and necrotizing pneumonia became more frequent during the last few years. The optimal therapeutic approach for such conditions is still controversial. Both pharmacological management (antimicrobials and fibrinolysis), and surgical management (pleural drainage and video-assisted thoracoscopic surgery), are the subject of continuous assessment. In this paper, the Spanish Society of Paediatric Infectious Diseases and the Spanish Society of Paediatric Chest Diseases have reviewed the available evidence. Consensus treatment guidelines are proposed for complications of community-acquired pneumonia in children, focusing on parapneumonic pleural effusion. Recommendations are also provided for the increasing population of patients with underlying diseases and immunosuppression.
A finales de los años 90, se apreció un aumento progresivo de los casos complicados de neumonía adquirida en la comunidad (NAC), fundamentalmente con derrame pleural1,2. Durante la siguiente década continuó su progresión, observándose una incidencia muy llamativa de casos de empiema pleural y formas necrosantes, principalmente de etiología neumocócica en niños mayores de 2 años3-5. Este cambio epidemiológico tuvo, probablemente, un origen multifactorial, incluido el desplazamiento de cepas neumocócicas en nasofaringe por el efecto de la vacuna antineumocócica 7-valente, aunque esta tendencia ya se apreció antes de su disponibilidad1,2. Esta nueva situación se relacionó, sobre todo, con la emergencia de varios serotipos, neumocócicos, como 1, 3, 5 y 19A3. Sin embargo, este fenómeno parece haberse controlado parcialmente desde la introducción, en el año 2010, de nuevas vacunas antineumocócicas que cubren esos serotipos emergentes, sobre todo la vacuna de 13-serotipos6,7.
A su vez, la etiología por Staphylococcus aureus (S. aureus) ha ido aumentando discretamente, incluyendo los resistentes a meticilina (SAMR) y las cepas productoras de ciertos factores de virulencia como la leucocidina Panton-Valentine (PVL, de sus siglas en inglés), capaces de conferir mayor gravedad clínica, mientras que otras, como Streptococcus pyogenes (S. pyogenes), continúan siendo poco frecuentes8.
Este documento de consenso está realizado por las sociedades españolas de Infectología Pediátrica (SEIP) y de Neumología Pediátrica (SENP), y en él se proponen unas pautas de tratamiento en los casos de NAC complicada, así como de actuación en situaciones especiales, completando los documentos previamente publicados en esta misma revista sobre diagnóstico8 y tratamiento de los casos no complicados y la prevención de la NAC9.
Los criterios de hospitalización de un niño con NAC pueden variar según la práctica asistencial de cada centro hospitalario. Este consenso ofrece unas recomendaciones consensuadas por los autores, apoyadas por guías internacionales10,11, que pueden consultarse en la tabla 1.
Propuesta de criterios de ingreso en planta de hospitalización y en UCIP del niño con neumonía adquirida en la comunidad
| Criterios de ingreso en planta de hospitalizaciónCriterios clínicosAspecto sépticoAfectación del estado generalTaquipnea moderada-graveTiraje-uso de musculatura respiratoria accesoria (cualquier grado), supraesternal, intercostal, subcostal; quejidoApneasSatO2 por debajo del 92% de forma mantenida con aire ambienteDeshidratación y/o trastornos electrolíticos relevantesDecaimiento-somnolenciaIncapacidad para la alimentaciónImposibilidad para la administración de antibioterapia oral (vómitos, familia incapaz de colaborar en el tratamiento…)Falta de respuesta al tratamiento empírico oral, correctamente utilizado, tras 48 h del inicioCriterios radiológicosAfectación multifocal en NAC de características típicasAbsceso pulmonarNeumatocelesAfectación pleural significativaPatrón intersticial graveImágenes radiológicas sospechosas de un microorganismo no habitualFactores de riesgo a tener en cuenta< 6-12 mesesEnfermedad de base, incluyendo:malnutricióninmunodeficienciafibrosis quísticabronquiectasiasdisplasia broncopulmonar asociada a prematuridadcardiopatíanefropatíadiabetesAmbiente higiénico-social deficiente. Supervisión familiar inadecuada |
| Criterios de ingreso en cuidados intensivos pediátricosShockDificultad respiratoria grave o agotamiento respiratorio, a pesar de oxígeno suplementarioApneas frecuentesHipoxemia (SatO2 ≤ 90%) a pesar de oxigenoterapia con FiO2 ≥ 0,5Hipercapnia progresiva (pCO2 ≥ 65-70, capilar o venosa)Afectación radiológica rápidamente progresivaNeumotóraxAlteraciones metabólicas gravesAfectación del nivel de consciencia |
FiO2: fracción inspiratoria de oxígeno; pCO2: presión de dióxido de carbono; SatO2: saturación de oxígeno; UCIP: unidad de cuidados intensivos pediátricos.
Si bien el tratamiento antibiótico de elección ofrece menos dudas, debería individualizarse en pacientes en ciertas situaciones. En casos complicados con derrame pleural, el abordaje terapéutico óptimo, tanto desde el punto de vista médico como técnico-quirúrgico, es más controvertido, por lo que será motivo de análisis.
Tratamiento de soporteEl niño hospitalizado por una NAC, además de la terapia antibiótica, precisa tratamiento de soporte, en parte ya expuestos en el consenso previo9 y que se completa a continuación.
MonitorizaciónPulsioximetría, que podría ser continua. Se debe medir la pCO2 si existe gravedad, pues la hipercapnia es un signo de fallo respiratorio inminente12.
Soporte respiratorioA) Oxigenoterapia: con cánulas nasales, mascarilla o carpa, si saturación de oxígeno (SatO2) basal ≤ 92%, alcanzándose FiO2 de hasta el 40% con las cánulas o hasta el 50% con mascarillas con efecto Venturi. Si esto es insuficiente, se deben emplear cánulas nasales de alto flujo, o mascarilla con reservorio y oxígeno al 100%, valorándose el ingreso en una unidad de cuidados intensivos en las horas siguientes (tabla 1), salvo en casos con limitación del esfuerzo terapéutico.
B) Asistencia respiratoria: excepcionalmente, es necesaria la conexión a ventilación mecánica del paciente con NAC. Existe cada vez más evidencia de los beneficios de la ventilación no invasiva13.
Abordaje de líquidos y electrolitosSe deben asegurar las necesidades basales por vía oral, o intravenosa si es necesario. En pacientes con cardiopatía clínicamente significativa puede ser precisa la restricción hídrica (2/3) y emplear diuréticos.
Una tercera parte de los pacientes puede presentar hiponatremia (< 135 mEq/l)14, que parece relacionarse más con las formas lobares de NAC y con una mayor gravedad14,15. La hiponatremia se atribuye habitualmente a una secreción inadecuada de hormona antidiurética (SIADH) aunque, en niños hipovolémicos, esta puede ser adecuada. Igualmente, se ha demostrado un aumento de péptido auricular natriurético en niños con NAC y SIADH. Para prevenir el desarrollo de hiponatremia en niños hospitalizados con NAC, se recomienda la administración de líquidos isotónicos.
Fisioterapia respiratoriaExiste escasa información. Se recomienda una postura semiincorporada para facilitar la expansión pulmonar10.
NutriciónLa malnutrición empeora el pronóstico. Los pacientes con mala tolerancia oral podrían precisar alimentación mediante sonda nasogástrica10.
CorticoidesEn adultos parecen acortar el tiempo de enfermedad16. En niños, 2 pequeños ensayos clínicos, uno en pacientes con NAC grave y otro en NAC por Mycoplasma, los corticoides han demostrado acortar la enfermedad17,18, incluso con megadosis en casos refractarios19. Actualmente se están desarrollando ensayos clínicos analizando su utilidad en la NAC y en el derrame pleural paraneumónico.
Tratamiento antibióticoTratamiento antibiótico en niños hospitalizados sin enfermedad de baseNeumonía adquirida en la comunidad típica de origen neumocócico sospechado o confirmadoLa causa más frecuente en las formas típicas continúa siendo Streptococcus pneumoniae (S. pneumoniae), que actualmente presenta un perfil de sensibilidad excelente frente a betalactámicos como penicilina, amoxicilina y ampicilina20. Por ello, en niños mayores de 3 meses con NAC de características típicas que precisen hospitalización (tabla 1), con sospecha o confirmación de la etiología neumocócica, el antibiótico de elección es ampicilina o penicilina G sódica, por vía intravenosa, a dosis altas, dada su excelente tolerancia11. Las 2 opciones son igualmente válidas, aunque la ampicilina presenta la ventaja de precisar menos dosis diarias, así como un ligero menor coste. En la tabla 2 puede consultarse la posología de estos antibióticos.
Tratamiento antibiótico del niño hospitalizado con neumonía adquirida en la comunidad de características típicas (con etiología neumocócica sospechada o confirmada), según la existencia de derrame pleural paraneumónico
| Tratamiento antibiótico recomendado | |
| Sin derrame pleural paraneumónico | Opciones igualmente válidas:– Ampicilina iv: 150-200mg/kg/día, cada 6 h (máximo 12 g/día)– Penicilina G sódica iv: 250.000-300.000 UI/kg/día, cada 4 h (máximo 24 millones UI/día) |
| Con derrame pleural paraneumónico | Opciones igualmente válidas:– Ampicilina iv: 250-300mg/kg/día, cada 6 h (máximo 12 g/día)– Penicilina G sódica iv: 300.000-400.000 UI/kg/día, cada 4 h (máximo 24 millones UI/día) |
Esta recomendación se basa fundamentalmente en opiniones de expertos recogidas en guías clínicas. No existen ensayos clínicos que comparen la eficacia de estos antibióticos con otros de más amplio espectro, aunque hay estudios retrospectivos que demuestran resultados superponibles21.
El paciente hospitalizado suele presentar buena evolución, pudiéndose pasar a amoxicilina oral tras 24-48 h de permanecer afebril. Se recomienda una duración total del tratamiento de 7-10 días.
Existe un empleo elevado e injustificado de cefalosporinas de tercera generación en niños ingresados con NAC. Así, en un estudio multicéntrico español, se observó que hasta el 34% recibió esta antibioterapia empírica inicialmente22.
Neumonía adquirida en la comunidad típica relacionada con otros patógenosEn la tabla 3 se recogen diferentes situaciones en las que se recomiendan otras pautas antibióticas.
Tratamiento antibiótico empírico en casos especiales de neumonía adquirida en la comunidad de características típicas, con o sin derrame pleural paraneumónico (emplear el límite alto de las dosis en caso de derrame pleural)
| Tratamiento antibiótico recomendado | |
| Menores de 6 meses | – Menores de 3 meses: ampicilina iv (200mg/kg/día, cada 6h)+cefotaxima iv (200mg/kg/día, cada 6h)– De 3 a 6 meses: amoxicilina-ácido clavulánico iv (proporción 10:1): 150mg/kg/día, cada 6h |
| Niños no vacunados frente a Haemophilus infuenzae tipo b | Opciones:– Amoxicilina-ácido clavulánico iv (proporción 10:1): 150mg/kg/día, cada 6h (máximo 2 g cada 6h)– Cefuroxima iv: 150mg/kg/día, cada 6-8h |
| Sospecha de Streptococcus pyogenesa | Penicilina G sódica iv (250.000 UI/kg/día, cada 4 h)+clindamicina iv (30-40mg/kg/día, cada 6h) |
| Sospecha de Staphylococcus aureus sensible a meticilinab | Opciones:– Cloxacilina iv (150-200mg/kg/día, cada 6h)+cefotaxima iv (200mg/kg/día, cada 4-6h)– Amoxicilina-ácido clavulánico iv (proporción 10:1): 150mg/kg/día, cada 6h (máximo 2 g cada 6h)– Cefuroxima iv: 150mg/kg/día, cada 6-8h |
| Absceso pulmonar y neumonía necrosantec | Cefotaxima iv (200mg/kg/día, cada 6h)+clindamicina iv (30-40mg/kg/día, cada 6-8h) |
| Sospecha de neumonía aspirativa | Amoxicilina-ácido clavulánico (proporción 10:1) iv: 150mg/kg/día, cada 6h (máximo 2 g cada 6h) |
| Alérgicos a betalactámicos | Alergia, no anafilaxia: cefalosporinas, preferiblemente cefuroxima, oral o ivAnafilaxia:– NAC leve-moderada: levofloxacino o glucopéptidosd– NAC grave: glucopéptidos+levofloxacino o macrólidos |
Situaciones que apoyan la posibilidad de S. pyogenes: varicela, antígeno neumocócico en líquido pleural negativo; exantema escarlatiniforme; frotis faríngeo positivo pare esta bacteria; estado séptico, mal estado general.
Situaciones que apoyan la posibilidad de S. aureus: neumonía necrosante y/o neumatoceles; datos microbiológicos, como presentar antígeno neumocócico en líquido pleural negativo, cocos grampositivos sospechosos en líquido pleural, hemocultivo positivo a esta bacteria; infección estafilocócica o de piel o de partes blandas previa; niños menores de 2-3 años con mala evolución con antibioterapia adecuada; estado séptico, mal estado general.
En niños no vacunados frente a Haemophilus influenzae (H. influenzae) tipo b y en niños menores de 6 meses se recomienda amoxicilina-clavulánico, salvo en menores de 3 meses, donde la pauta recomendada es ampicilina-cefotaxima.
En ciertas situaciones, sobre todo en casos graves, se deben tener en cuenta otras bacterias, como S. aureus y S. pyogenes, pudiendo precisar otras pautas de tratamiento antibiótico (tabla 3). Para las formas necrosantes, que ocurren en el 0,8% de las NAC (6% de las NAC hospitalizadas), relacionadas en nuestro medio con S. aureus (habitualmente meticilin-sensibles, pero productoras de PVL), seguido de S. pneumoniae5, se recomienda tratamiento empírico con cefotaxima y clindamicina, al menos durante 14-21 días.
En niños con NAC asociada a infección gripal10, habitualmente producida por S. pneumoniae o, en menor medida, S. aureus, S. pyogenes y H. influenzae5,23, se recomienda el empleo empírico de amoxicilina-clavulánico en vez de amoxicilina o ampicilina.
En una NAC con sospecha de origen bacteriano en un niño con varicela, se recomiendan antibióticos que cubran a S. pyogenes y S. aureus, como cefuroxima o, en casos más graves, la asociación de penicilina G o cefotaxima junto a clindamicina, fundamentalmente si existe neumonía necrosante y signos de shock tóxico24.
Neumonía adquirida en la comunidad complicada con derrame pleural paraneumónicoSe recomienda emplear los mismos antibióticos (ampicilina o penicilina) que en las NAC sin derrame pleural (tabla 2), salvo excepciones que se recogen en la tabla 310,11, aunque a dosis más elevadas para alcanzar concentraciones adecuadas en el espacio pleural25.
Se recomienda pasar a vía oral cuando el paciente lleve 48 h afebril y prolongar la duración del tratamiento entre 2 y 4 semanas, dependiendo del agente causal, aunque en casos muy tórpidos o graves, podría ser necesario mantenerlo más días.
Neumonía adquirida en la comunidad atípicaEstos casos, principalmente causados por infecciones virales, sobre todo en menores de 4-5 años, habitualmente no precisan ingreso hospitalario ni antibióticos. En mayores de 4-5 años, donde la etiología por Mycoplasma pneumoniae es más frecuente, y en mucha menor medida por Chlamydophila pneumoniae, se recomienda el empleo de macrólidos por vía oral, y si no es posible, por vía intravenosa11.
Los más empleados son claritromicina y azitromicina, a las mismas dosis por vía oral que por vía intravenosa, siendo azitromicina mejor tolerada11 (véase la tabla 4). Eritromicina está en desuso por sus efectos adversos, incluida la flebotoxicidad con la administración intravenosa, y su complicada posología (cada 6 h, 10-14 días).
Neumonía adquirida en la comunidad de características atípicas, con etiología confirmada o con alta sospecha de Mycoplasma o Chlamydophila. Macrólidos más empleados (mismas dosis por vía oral que por vía intravenosa)
| Nombre | Posología | Duración |
|---|---|---|
| Azitromicina | 10mg/kg cada 24 h(dosis máxima: 500mg/día)a | 3 días |
| Claritromicina | 15mg/kg/día, cada 12 h (dosis máxima: 1 g/día) | 7 días |
En EE. UU. se utiliza la misma dosis total, pero distribuida a lo largo de 5 días (primer día: 10mg/kg, con un máximo de 500mg; entre los días 2 y 5: 5mg/kg cada 24 h, máximo 250mg/día), porque es la posología aprobada por la FDA, pero no tiene ninguna ventaja sobre la pauta de 3 días aprobada por la Agencia Europea del medicamento (EMA).
La gripe puede ser tratada con antivirales, no existiendo cepas resistentes a oseltamivir en España. Existen dudas razonables sobre su efectividad en pacientes hospitalizados sin factores de riesgo26, por lo que debe reservarse para pacientes hipoxémicos o graves, sobre todo en aquellos con enfermedad de base relevante.
Neumonía adquirida en la comunidad grave que precisa ingreso en Unidad de Cuidados Intensivos PediátricosEl espectro etiológico es más amplio: S. pneumoniae, S. aureus, S. pyogenes, entre otros. Este consenso recomienda cefotaxima, a la que podría asociarse un antibiótico con actividad antiestafilocócica como cloxacilina u otros (tabla 5). Debido a la asociación de S. aureus, incluyendo SAMR, y gripe, el empleo de clindamicina (o vancomicina, dependiendo de los datos locales de sensibilidad) junto a una cefalosporina (cefuroxima o cefotaxima) sería apropiada.
Tratamiento antibiótico recomendado en el niño con neumonía adquirida en la comunidad/derrame pleural grave que precisa ingreso en la UCIP
| NAC típica | – Cefotaxima (200-300mg/kg/día, cada 6h)+uno de los siguientesa– Cloxacilina iv (150-200mg/kg/día, cada 6h)o– Clindamicina iv (30-40mg/kg/día, cada 6-8h)b,o– Vancomicina iv (60mg/kg/día, cada 6h)c+/–Macrólido iv (eritromicina 40mg/kg/día cada 6h, o claritromicina 15mg/kg/día, cada 12h; o azitromicina 10mg/kg/día, cada 24h) |
| NAC intersticial | – Cefotaxima (200mg/kg/día)+macrólido iv (eritromicina, claritromicina o azitromicina)+/–– Cotrimoxazol iv (20mg de trimetoprima/kg/día, cada 6h)d |
h: horas; iv: vía intravenosa; SAMR: Staphylococcus aureus resistente a meticilina; UCIP: Unidad de Cuidados Intensivos Pediátricos.
En adultos, la asociación de un macrólido mejora la supervivencia27, pero no hay datos similares en niños. En un estudio en niños mayores de 5 años, hospitalizados por NAC de gravedad variable, se objetivó menor estancia hospitalaria28.
Tratamiento antibiótico en pacientes con enfermedades de baseAunque las neumonías que habitualmente presenten estos pacientes son de origen comunitario, estas pueden presentar características especiales: gran variedad de microorganismos potencialmente implicados, coinfecciones frecuentes, amplia diversidad de hallazgos clínicos y gravedad potencial incrementada. Esta situación condiciona más pruebas diagnósticas y tratamientos más agresivos.
Los posibles agentes etiológicos dependen de la enfermedad de base (tabla 6) y de las características de los hallazgos radiográficos. En general, hay que pensar en patógenos habituales, como virus respiratorios y S. pneumoniae, pero también en H. influenzae no tipificable12.
Microorganismos más comúnmente asociados a neumonía en niños con algunas enfermedades de base gravesa
| Enfermedad de base | Principales agentes etiológicos | Tratamientos más empleados |
|---|---|---|
| Inmunodeficiencia humoral | S. pneumoniae, H. influenzaeMenos frecuentes: Salmonella, Pseudomonas, S. aureusEnterovirus | Amoxicilina-clavulánico, cefotaxima |
| Inmunodeficiencia combinadab | – Bacterias encapsuladas, Listeria, P. aeruginosa, Stenotrophomonas, Burkholderia cepacia, Legionella, Nocardia– VVZ, rubeola, VHS, CMV, adenovirus, VRS, influenza, parainfluenza, MTPh– MAC, M. fortutitum, BCG, otras micobacterias oportunistas. Reactivación de M. tuberculosis– Pneumocystis jirovecii, Aspergillus, C. albicans, Cryptococcus | Cefotaxima, cefepima, cotrimoxazol, aciclovir, antifúngicos (fluconazol, voriconazol, anfotericina B liposomal) |
| Alteraciones fagocitarias/neutropenia | S. aureus, P. aeruginosa, Stenotrophomonas, B. cepaciaS. marcescens, enterobacterias como Salmonella, E. colic. Nocardia. BCG, micobacterias no tuberculosasdAspergillus, Candida. | Amoxicilina-clavulánico, cefotaxima. Cloxacilina, clindamicina, vancomicina. Cotrimoxazol. Piperacilina-tazobactam, cefepima o meropenem. Antifúngicos (voriconazol, anfotericina B liposomal) |
| Infección VIH | S. pneumoniae, H. influenzae, S. aureus. Micobacterias. Pneumocystis. CMV, VHS | Amoxicilina-ácido clavulánico, cefotaxima.Cotrimoxazol. Aciclovir. |
| TPH | Múltiples. Depende del momento del trasplante, existencia de EICH, tratamiento IS y profilaxis antimicrobiana. Siempre bacterias encapsuladas | Igual que inmunodeficiencia combinada |
| TOS | Múltiples. Depende del momento del trasplante, tratamiento IS y profilaxis antimicrobiana. Siempre bacterias encapsuladas | Igual que inmunodeficiencia combinada |
| Complemento | S. pneumoniae, H. influenzae | Cefotaxima |
| Drepanocitosis/asplenia | S. pneumoniae, H. influenzae, Salmonella, y otros encapsulados | Cefotaxima |
| Síndrome nefróticoe | S. pneumoniae, H. influenzae, enterobacterias. Virus respiratorios | Amoxicilina-clavulánico, cefuroxima o cefotaxima |
| Enfermedad reumática o antiinflamatoriae | S. pneumoniae, H. influenzae y otras bacterias encapsuladas | Amoxicilina-clavulánico, cefuroxima o cefotaxima. Levofloxacino |
| Fibrosis quísticaf | P. aeruginosa, S. aureus, Burkholderia, Stenotrophomonas. H. influenzae. Aspergillus (aspergilosis broncopulmonar alérgica) | Amoxicilina-ácido clavulánicogCeftazidima, piperacilina-tazobactam, meropenem, más un aminoglucósido, o bien ciprofloxacino. Cloxacilina |
| Cardiopatía | Patógenos comunes. Virus respiratorios | Amoxicilina-clavulánico, cefuroxima o cefotaxima |
BCG: bacilo Calmette-Guérin; CMV: citomegalovirus; IS: inmunosupresor; MAC: Mycobacterium avium-complex; MTPh: metapneumovirus humano; TBC: tuberculosis; TOS: trasplante de órgano sólido; TPH: trasplante de progenitores hematopoyéticos; VHS: virus herpes simple; VIH: virus de la inmunodeficiencia humana; VRS: virus respiratorio sincitial; VVZ: virus varicela zóster.
Se debe pensar siempre en microorganismos que producen NAC en niños sanos, especialmente virus respiratorios y S. pneumoniae, y, en menor medida, H. influenzae. El grado de inmunodepresión, los antecedentes inmediatos (hospitalización reciente, quimioprofilaxis, vacunas previas) y la situación clínica del paciente, de forma conjunta, deben guiar al clínico en cuanto a la agresividad del abordaje del paciente (necesidad de ingreso, pruebas diagnósticas y microbiológicas invasivas, asociación de antibióticos, empleo de antivirales y antifúngicos).
Una depresión de la inmunidad celular podría dar lugar a una hiperinfestación por Strongyloides stercoralis (descartar ante eosinofilia grave; importante saber el país de origen del paciente).
Importante las infecciones endémicas del país de origen; se ha visto que en adultos con neoplasias hematológicas la incidencia de TBC es muy elevada en personas inmigrantes.
Especialmente importante en la deficiencia de receptor de IF-γ e IL-12, donde Salmonella y Listeria también podrían estar implicadas.
Dependerá, en gran medida, del tratamiento inmunosupresor al que estén sometidos, pudiendo presentar infecciones por patógenos oportunistas. Por ejemplo, la administración de anti-TNF y corticoides a dosis inmunosupresoras se ha asociado a reactivación de tuberculosis y a infecciones por Cryptococcus, Aspergillus, Listeria, Pneumocystis, VHS, VVZ y CMV, entre otros.
En pacientes no gravemente inmunodeprimidos, la mayoría del panel considera adecuado iniciar empíricamente amoxicilina-clavulánico, cefuroxima o cefotaxima, con la posibilidad de añadir un inhibidor de la neuraminidasa (oseltamivir), si se detecta virus de la gripe. En pacientes con mayor grado de inmunodepresión, se debería valorar añadir un macrólido si existen infiltrados pulmonares difusos, e incluso cotrimoxazol, si se sospecha Pneumocystis.
Fracaso terapéuticoSe acepta como tal el desarrollo de insuficiencia respiratoria o la persistencia de taquipnea a las 72 h del inicio del cuadro, así como la persistencia de fiebre o afectación del estado general, 48-72 h tras el ingreso10. Sin embargo, en este último caso, si el paciente mejora y descienden los reactantes de fase aguda, fundamentalmente la proteína C reactiva, probablemente no se trata de un fracaso del tratamiento antibiótico.
Cuando se considere que sí existe un fracaso terapéutico, a las 48-72 h de su inicio, es necesario realizar una evaluación clínica, radiológica y analítica, y revisar las causas más frecuentes (tabla 7)10,29.
Causas más frecuentes de fracaso terapéutico en la neumonía adquirida en la comunidad
| 1. Derrame pleural, neumonía necrosante o absceso pulmonar2. Microorganismo no susceptible, fundamentalmente viral. Puede valorarse iniciar un macrólido si existe sospecha de Mycoplasma. En otras ocasiones, es la primera manifestación de tuberculosis3. Incumplimiento terapéutico o dosis insuficiente4. Problema de base conocido del paciente, como inmunodepresión, desnutrición, asma, fibrosis quística5. Diagnóstico alternativo, como aspiración de cuerpo extraño, malformación pulmonar o hernia diafragmática |
Alrededor del 20-40% de niños hospitalizados con NAC presentarán derrame pleural y hasta un 0,6% progresará hacia empiema30.
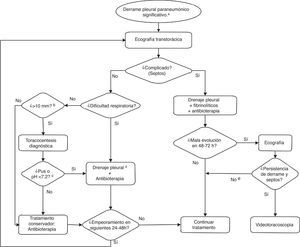
Aproximadamente, la mitad de casos con derrame pleural paraneumónico se resuelven con tratamiento antibiótico sin precisar medidas invasivas30. La situación clínica (sobre todo la dificultad respiratoria) y el tamaño del derrame son determinantes en la toma de decisiones. En la figura 1, se expone el algoritmo de actuación recomendado ante el derrame pleural paraneumónico.
Algoritmo de actuación ante un derrame pleural paraneumónico significativo. a) El derrame pleural no significativo (pinzamiento, volumen mínimo) se abordará como neumonía no complicada. b) En casos seleccionados, se podría realizar toracocentesis diagnóstica con un volumen menor. c) Estos hallazgos, de disponibilidad rápida, son indicación de drenaje pleural inmediato, en el mismo acto asistencial. Otros hallazgos en el líquido pleural, cuyos resultados se pueden demorar en el tiempo, como: visualización de bacterias con la tinción de Gram, cultivo positivo, LDH > 1.000 UI/ml, glucosa < 40-60mg/dl, podrían servir para la indicación de drenaje pleural a posteriori. Estos datos bioquímicos, junto al recuento leucocitario, están en desuso para la toma de decisiones. En líquido pleural, la positividad de la PCR a alguna bacteria o el antígeno neumocócico (BinaxNow) positivo no se tomarán como criterios aislados para la decisión de colocar un tubo pleural. d) En ausencia de empiema, en determinadas circunstancias y pacientes, y si no hay disponibilidad a corto plazo de personal con formación en la colocación y mantenimiento de un drenaje pleural, se podría considerar la toracocentesis evacuadora. e) Considerar otras causas de mala evolución: neumonía necrosante, absceso pulmonar.
Siempre que exista un derrame pleural moderado-grande, o dudas de la existencia o tamaño de un derrame pequeño en la radiografía, se debe realizar una ecografía torácica. Se deben especificar la cuantía y las características ecográficas del derrame, así como el punto o puntos óptimos para posible punción, buscando el área de mayor espesor con mejor accesibilidad técnica, que suele estar entre el 5.° y el 7.° espacios intercostal a nivel de línea axilar media-posterior. No se debe realizar punción si el derrame es subpulmonar. La punción de derrames menores de 10mm no se realiza de forma rutinaria11.
La toracocentesis se realizará en una sala equipada adecuadamente (anestesia, UCIP o quirófano), aunque puede haber otras áreas igualmente equipadas en Urgencias o plantas de hospitalización. Se recomienda que la colocación de un tubo de drenaje pleural se realice en una unidad de cuidados intensivos o en quirófano.
Se debe colocar un tubo pleural si el derrame presenta una o más características de empiema pleural o si ocasiona dificultad respiratoria moderada-grave. Un derrame complicado, con septos, precisa no solo drenaje pleural con un tubo, sino también administración de fibrinolíticos y, si la evolución no es favorable, la realización de una videotoracoscopia (VATS, de sus siglas en inglés).
Se emplean catéteres de tamaño variable. La Asociación Americana de Cirujanos Pediátricos recomienda utilizar catéteres de 12 F31. En un reciente estudio multicéntrico español se utilizaron drenajes de 12-14 F32, aunque, en otros estudios, se usan de 8-10 F33. Catéteres más finos (8-14 F) son tan efectivos como los de mayor tamaño, producen menos dolor y reducen los días de hospitalización34. No se recomienda usar trocares, sino los actuales tubos blandos, de pequeño tamaño, mediante técnica de Seldinger. Está indicado un control radiográfico para comprobar la posición del tubo y descartar neumotórax. El tubo se conecta a un sistema de vaciado con flujo unidireccional, que debe mantenerse siempre por debajo de la altura del tórax del paciente. La indicación de colocar aspiración no está clara, pero parece que mejora la extracción de líquido. Si se realiza, tiene que hacerse con un sello de agua, a una presión de 5-10cm de agua.
Se aconseja cerrar el drenaje durante una hora cuando alcanza una cantidad de 10ml/kg. En niños mayores o adolescentes, se recomienda no drenar más de 1,5 l de una vez, o hacerlo lentamente a unos 500ml/h.
Se suele retirar el tubo de drenaje cuando el débito de líquido es mínimo (< 40-60ml/24 h)32,33. Algunos autores preconizan mantener el tubo hasta que el débito de líquido seroso sea menor de 1ml/kg/día durante las 12 h previas. Puede ayudar a tomar esta decisión la ausencia de una cantidad significativa de líquido en la ecografía11. Para retirar el drenaje no es necesario pinzar el tubo previamente.
FibrinolíticosSe propone emplear fibrinolíticos como primera opción en el derrame pleural con septos, ya sean flotantes o formando loculaciones o tabiques (fig. 1)31,32. Su empleo ha demostrado ser coste-efectivo respecto a la colocación de tubos de drenaje sin fibrinolíticos35. En ausencia de septos en la ecografía, pero con escasa salida de líquido para lo esperado, sobre todo cuando este es espeso, y una vez descartadas otras causas, puede barajarse la posibilidad de hacer una prueba terapéutica con fibrinolíticos.
En cuanto al tipo de fibrinolítico, este consenso recomienda uroquinasa, con más experiencia en niños.
En los ensayos clínicos que comparan la uroquinasa intrapleural con la VATS en niños32,33, no se observaron diferencias entre ambas medidas. En un reciente ensayo clínico multicéntrico realizado en España, se comparó la utilidad de la uroquinasa con la VATS en 103 niños con derrame pleural tabicado32. Los resultados mostraron que la administración de uroquinasa es tan efectiva como la VATS en el tratamiento del empiema pleural tabicado, no habiendo diferencias, tras su instauración, en la duración de la estancia hospitalaria32.
Estos resultados apoyan la recomendación actual de la Asociación Americana de Cirugía Pediátrica de utilizar la fibrinólisis como tratamiento inicial en estos pacientes dado su menor coste y mayor simplicidad, al no requerir una intervención quirúrgica31-33,36.
Las dosis de uroquinasa empleadas por diferentes autores oscila entre 10.000 y 100.000 UI37. La posología recomendada por este consenso es la siguiente32:
- –
Niños<1 año: 10.000 unidades en 10ml de solución salina al 0,9%.
- –
Niños≥1 año: 40.000 unidades en 40ml de solución salina al 0,9%.
Se administra a través del tubo intrapleural (manteniéndolo pinzado posteriormente durante 4 h), 2 veces al día, durante 3 días32,33. Se pueden utilizar dosis adicionales si, tras esas 6 administraciones, la respuesta es incompleta37.
La administración de fibrinolíticos a través del tubo intratorácico puede causar molestias, por lo que deben aplicarse junto a una analgesia adecuada. Igualmente, podría provocar un ligero sangrado y, en raras ocasiones, reacciones de hipersensibilidad inmediata.
La terapia fibrinolítica debe suspenderse si no es efectiva, lo que puede ocurrir en derrames muy organizados, y no debe plantearse en pacientes con fístula broncopleural o cuando se aprecie burbujeo en los tubos de drenaje pleural, lo que sugeriría una fuga de aire. En este caso, el pinzamiento del tubo podría provocar un neumotórax a tensión. Los tubos de drenaje se deberían abrir de inmediato si el niño presenta signos de deterioro clínico, como aumento de la dificultad para respirar o dolor torácico.
VideotoracoscopiaLa VATS permite determinar el estadio del derrame, romper los tabiques, drenar el material fibrinopurulento, reducir la carga bacteriana en los estadios iniciales y colocar el tubo de drenaje en la posición correcta. Además, permite visualizar el aspecto del pulmón subyacente, su capacidad de expansión y la localización de fístulas broncopleurales.
Actualmente, existen 2 indicaciones aceptadas para la VATS:
- –
Persistencia de derrame moderado-masivo con compromiso respiratorio a pesar del tratamiento con drenaje y fibrinolíticos durante 2-3 días11, lo que suele ocurrir en el 15% de casos33,36.
- –
Complicaciones como fístulas broncopleurales33.
También puede ser una opción alternativa como tratamiento inicial del derrame significativo muy fibrinopurulento y organizado, en el que se desarrolla una capa gruesa o fibrosa, o en caso de no tener disponibilidad para la realización de fibrinólisis31,38. Su priorización debe individualizarse, teniendo en cuenta la duración y las características del derrame, así como la disponibilidad y la experiencia quirúrgica del centro en la realización de VATS. En niños no suele ser necesaria la decorticación.
La eficacia de la VATS en el tratamiento del empiema es bastante alta. En relación con el drenaje simple sin fibrinolíticos, la VATS disminuye considerablemente la duración de los síntomas (la fiebre suele resolverse en 24-72 h), la estancia hospitalaria, que se reduce a 6-7 días, y el coste31,39. En cambio, su eficacia parece similar a la del tratamiento con drenaje y fibrinolíticos32,33,36,40. El coste de la VATS se estima superior al de la fibrinólisis33,35,36, aunque algunos autores opinan que la VATS realizada precozmente podría ser más eficaz y ahorrar costes38.
La tasa de complicaciones es baja (6-7%), incluyendo la fuga aérea o el neumotórax persistente, neumatocele o sangrado38.
Conflicto de interesesConflicto de intereses de los autores con relación al documento (en los últimos 5 años):
- –
DMP ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en un ensayo clínico de Novartis y como consultor en Advisory Board de Astra-Zeneca y Pfizer.
- –
AAM no presenta conflicto de intereses.
- –
ATG ha colaborado en actividades de investigación subvencionadas por Pfizer.
- –
AEM ha colaborado en actividades docentes subvencionadas por Novartis, como investigador en un estudio multicéntrico auspiciado por GlaxoSmithKline y como consultor en un Advisory Board de Gilead.
- –
JFM ha colaborado en actividades docentes subvencionadas por Gilead y Abbvie.
- –
JGG ha colaborado en actividades docentes subvencionadas por Pfizer y Sanofi Pasteur MSD.
- –
AMG ha participado como consultor en Advisory Board de Abbvie y Gilead, ha recibido ayudas de investigación institucional de Abbvie y ayudas para asistencia a congresos de Abbvie, Actelion, Ferrer, GlaxoSmithKline y Novartis.
- –
CRGL ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline y como consultor en Advisory Board de Astra-Zeneca, Novartis, GlaxoSmithKline y Pfizer.
- –
JSL ha colaborado como investigador en ensayos clínicos de GlaxoSmithKline y Roche.
Moreno-Pérez D [Grupo de Trabajo de Infecciones Respiratorias. Sociedad Española de Infectología Pediátrica (SEIP)], Andrés Martín A [Sociedad Española de Neumología Pediátrica (SENP)], Tagarro García A, Escribano Montaner A [Sociedad Española de Neumología Pediátrica (SENP)], Figuerola Mulet J [Sociedad Española de Neumología Pediátrica (SENP)], García García JJ [Grupo de Trabajo de Infecciones Respiratorias. Sociedad Española de Infectología Pediátrica (SEIP)], Moreno-Galdó A [Sociedad Española de Neumología Pediátrica (SENP)], Rodrigo Gonzalo de Lliria C [Grupo de Trabajo de Infecciones Respiratorias. Sociedad Española de Infectología Pediátrica (SEIP)], Saavedra Lozano J [Grupo de Trabajo de Infecciones Respiratorias. Sociedad Española de Infectología Pediátrica (SEIP)].
Los nombres de los miembros de la sociedad están mencionado en el anexo.